
【题目】某离子化合物中,阳离子和阴离子的电子层结构与氖原子电子层结构相同,则此离子化合物化学式为( )
A. MgOB. NaClC. SiO2D. K2S
科目:高中化学 来源: 题型:
【题目】下列物质间的反应,其能量变化符合如图所示的是( ) 
A.铝粉与氧化铁在加热条件下的反应
B.灼热的碳与二氧化碳反应
C.Ba(OH)28H2O晶体和NH4Cl晶体混合
D.碳与水高温条件下制取水煤气的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验). 
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸.
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹.
Ⅲ.当B中溶液由黄色变为棕色时,关闭活塞a.
Ⅳ.…
(1)A中产生的是黄绿色气体,其电子式是 , 在该反应中浓盐酸表现了性和性.
(2)验证氯气的氧化性强于碘的实验现象是 .
(3)B中溶液发生反应的离子方程式是 .
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 .
(5)过程Ⅲ实验的目的是 .
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下 , 得电子能力逐渐减弱.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)2SO3(g)△H<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的( ) 
A.图Ⅰ研究的是t0时刻增大O2的物质的量浓度对反应速率的影响
B.图Ⅱ研究的是t0时刻通入氦气增大体系压强对反应速率的影响
C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲的催化效率比乙高
D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图a、b、c、d均为铂电极,供选择的电解质溶液如下表:
组 | A | B | C | D |
甲槽 | NaOH | Cu(N O3)2 | KCl | Na2SO4 |
乙槽 | CuSO4 | NaCl | AgNO3 | NaNO3 |
要满足的条件是:①工作一段时间后,甲槽电解液pH上升,而乙槽电解液pH下降;②b、c两极放电离子的物质的量相等.则应选用的电解液是( )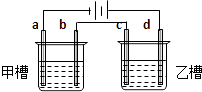
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:
N2(g)+3H2(g)2NH3(g),△H<0,在673K,30MPa下,n(NH3)和n(H2)随时间变化的关系如图所示,叙述正确的是( )
A.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
B.点c处反应达到平衡
C.点a的正反应速率比点b的大
D.其他条件不变,773 K下反应至t1时刻,n(H2)比图中d点的值小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组设计了如图1装置证明和比较SO2和氯水的漂白性,其中A装置分液漏斗中为70%的硫酸,烧瓶中为亚硫酸钠固体,B、D中为品红溶液,C中为NaOH溶液. 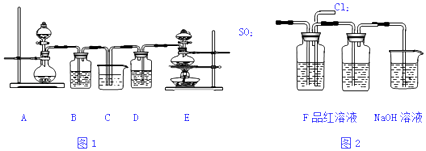
(1)实验时用装置A制备SO2气体,写出反应的化学方程式
(2)反应开始后,发现B、D两个装置中的品红溶液都褪色,停止通气后,取B、D溶液于试管中分别加热,两个试管中的现象分别为:BD . 解释B中对应现象的原因 .
(3)装置C的作用是
(4)该实验小组的甲、乙两位同学利用上述两发生装置按如图装置继续进行实验:
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅.试根据该实验装置和两名同学的实验结果回答问题.
①两同学在气体进入品红溶液之前,先将气体通过F装置,F中可盛装浓硫酸.其目的是使SO2和Cl2混合均匀并且 .
②试分析甲同学实验过程中,品红溶液不褪色的原因是:(用离子方程式说明)
③你认为乙同学是怎样做到让品红溶液变得越来越浅的?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”.以钛铁矿(主要成分FeTiO3 , 钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如图1: 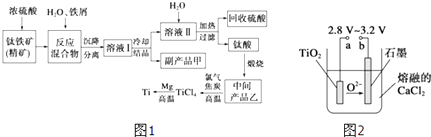
回答下列问题:
(1)钛铁矿和浓硫酸反应的产物之一是TiOSO4 , 反应中无气体生成.副产品甲阳离子是 .
(2)上述生产流程中加入铁屑的目的是 .
(3)此时溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子.常温下,其对应氢氧化物的Ksp如下表所示.
氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
Ksp | 8.0×10﹣16 | 1.0×10﹣29 | 1.8×10﹣11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018molL﹣1 , 当溶液的pH等于时,Mg(OH)2开始沉淀.
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,写出该反应的离子方程式:
(4)Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是 .
(5)在800~1000℃时电解TiO2也可制得海绵钛,装置如图2所示.图中b是电源的极,阴极的电极反应式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com