
����������ز�Ʒ�����������Ӧ�ù㷺��
��1�����������ж����壬��ʵ���ҽ������ʵ��ʱ�����������β�������⣬��Ӧע��������� �����������������ȹ�����й©��Ӧ ���˳�硱����硱����ɢ������Ա����ϡNaOH��Һ�������� �����û�ѧ����ʽ��ʾ��
��2���� ʵ���ҳ���NaOH��Һ���ն���������������Լ�Ҳ������������������ ������ĸ����
a. NaCl��Һ b. FeSO4��Һ c. Na2SO3��Һ
�� д��������ѡ��������Լ���Cl2��Ӧ�����ӷ���ʽ�� ��

��3����ͥ�г�������Һ����Ҫ�ɷ�NaClO�������飨��Ҫ�ɷ����ᣩ���������ijƷ������Һ��װ��˵������ͼ��

�ٷ������Խ�����Ʒ�и�ʴ���á���ԭ�� ��
���衰�ܱձ��桱��ԭ�� ��
�ۡ�������ͬʱʹ�á�������ж���������д����Ӧ�����ӷ���ʽ�� ��
��4���������������ĺ�������0.1 mg/m3�ͻ������ж���ijҺ������������һ�βⶨ�����������ĺ���ʱ�����������0.001 mol/L��KI��Һ 100 mL��Ϊ���жϿ����������ĺ����Ƿ꣬����Ҫ��õ������� ��
��1��ͨ�磻��磻Cl2 + 2NaOH =NaCl + NaClO + H2O����2�� �� b c���� 2Fe2+ + Cl2 = 2Fe3+ + 2Cl- SO32- + Cl2 + H2O =SO42- + 2Cl- + 2H+����3���� NaClO��ǿ�����ԣ���һ��������н�ǿ��ԭ�ԣ��� ����Һ����Ч�ɷ�NaClO��������е�CO2���ã�ʹ����ʣ��� Cl- + ClO- + 2H+ = Cl2��+ H2O����4��ͨ������������
��������
���������(1)������ʵ��ʱ��Ҫע��ͨ�磬��Ϊ�����ж���Ҫ��ֹ�ж�����д��ͨ�硱���Ϸ��������ĺ����ܵͣ��Ƚϰ�ȫ����������������Ⱦ�������Ҫ�����ɢ��Cl2�ͼ�Һ�ܷ�����Ӧ��������β�������ü�Һ���գ�Cl2��2NaOH=NaCl��NaClO��H2O��(2)��Cl2����ǿ�����ԣ������뻹ԭ�Ե����ʷ�����Ӧ���Ȼ�����Һ����������Ӧ��a����b��Fe2�����л�ԭ�ԣ�2Fe2����Cl2=2Fe3����2Cl������ȷ��c��SO32�����л�ԭ�ԣ�H2O��SO32����Cl2=SO42����2Cl����2H������ȷ�����bc��ȷ����2Fe2����Cl2=2Fe3����2Cl����H2O��SO32����Cl2=SO42����2Cl����2H������3����NaClO����Ư�����ã�������NaClO�������ԣ����������л�ԭ�ԣ�������������ԭ��Ӧ���Խ�����ʴ��ԭ��NaClO��ǿ�����ԣ���һ��������н�ǿ��ԭ�ԣ�HClO����������̼�ᣬ2NaClO��CO2��H2O=Na2CO3��2HClO��2HClO 2HCl��O2����NaClO��ʧЧ����Ҫ�ܷⱣ�棬ԭ���ǣ�����Һ����Ч�ɷ�NaClO��������е�CO2���ã�ʹ����ʣ�������Һ�ijɷ���NaClO������Cl�ǣ�1�ۣ������ijɷ������ᣬ����Cl��1�ۣ�����������ԭ��Ӧ�Ĺ��й��ɣ�Cl- + ClO- + 2H+ = Cl2��+ H2O����4��Cl2��2I��=I2��2Cl��������100mL0.001mol��L��1KI��Һ��ͬʱ����l����������
2HCl��O2����NaClO��ʧЧ����Ҫ�ܷⱣ�棬ԭ���ǣ�����Һ����Ч�ɷ�NaClO��������е�CO2���ã�ʹ����ʣ�������Һ�ijɷ���NaClO������Cl�ǣ�1�ۣ������ijɷ������ᣬ����Cl��1�ۣ�����������ԭ��Ӧ�Ĺ��й��ɣ�Cl- + ClO- + 2H+ = Cl2��+ H2O����4��Cl2��2I��=I2��2Cl��������100mL0.001mol��L��1KI��Һ��ͬʱ����l���������� ��71��103mg���ж��Ƿ꣬����Ҫ֪��ͨ��������������Ϊ�����������ĺ�������0.1 mg/m3�ͻ������ж���
��71��103mg���ж��Ƿ꣬����Ҫ֪��ͨ��������������Ϊ�����������ĺ�������0.1 mg/m3�ͻ������ж���
���㣺�������������ʺ�������ԭ��Ӧ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ��һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���и��������У�ǰһ���ǻ������һ���ǻ�������
A�������ྻ����ˮ B������ˮ������
C���������أ���ͭ80%������ͭ D�����ף�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�����з�һ�����У�߶���ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
�ڲ�ͬ�����·ֱ��N2��g��+3H2��g�� 2NH3��g���ķ�Ӧ���ʣ����б�ʾ�÷�Ӧ����������
2NH3��g���ķ�Ӧ���ʣ����б�ʾ�÷�Ӧ����������
A��v (N2)��3 mol��L-1��min-1 B��v (NH3)��2 mol��L-1��s-1
C��v (H2)�� 2.5mol��L-1��s-1 D��v (NH3)��10mol��L-1��min-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�����з�̨����һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���з�Ӧ�����ӷ���ʽ��д��ȷ����
A����ϡ�����м�������������Һ��OH-+ H+ == H2O
B��ͭ��ϡ���ᷴӦ��Cu +2NO3�� + 4H+ === Cu2+ + 2NO2��+ 2H2O
C�����Ȼ�����Һ�м��������ˮ��Al3+ + 3NH3H2O === Al(OH)3��+ 3NH4+
D�����Ȼ�����Һ�м������ͭ��Fe3+ +Cu === Fe +Cu2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�����з�̨����һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����й�������;��˵���У�����ȷ����
A�������������������ά B���������ƿ���DZˮͧ�еĹ�����
C��������������ʴ���� D��Ư�ۿ�������Ӿ�ص�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�����г�������һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
H2O2����Ҫ�Ļ���ԭ�ϡ�
��1��H2O2��OԪ�صĻ��ϼ�Ϊ______��
��2����������KMnO4��Һ�еμ�H2O2��Һ����Һ��ɫ��������H2O2�Ļ�ԭ�ԣ��������������ǣ�H2O2��______���ѧʽ����
����H2SO4�ữ��FeSO4��Һ�еμ�H2O2��Һ����Һ��ɻ�ɫ��������H2O2�������ԣ���Ӧ�����ӷ���ʽ��_________��
��3��H2O2���ȶ��ֽ⡣ʵ������Ҫ448 mL O2����״��������������������Ҫ��30%��H2O2��Һ���ܶ�Ϊ1.10 g/mL��_______mL��������������һλС����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�����г�������һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����������ʵ�ķ���ʽ����ȷ����
A��Al����NaOH��Һ��2Al + 2H2O + 2NaOH ==2NaAlO2 + 3H2��
B��ʢ��NaOH��Һ���Լ�ƿ�����ò�������SiO2 + 2OH-=SiO32- + H2O
C���ȵ�ŨNaOH��Һ��NH4ClҺ��ϲ������壺NH4+ + OH- NH3��+ H2O
NH3��+ H2O
D�����ȵ�Fe˿��ˮ�Ӵ��������γ�����ɫ�����㣺2Fe + 3H2O(g)  Fe2O3 +3H2��
Fe2O3 +3H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ������ѧ�ڵ�����ͳ�����ۻ�ѧ�Ծ��������棩 ���ͣ������
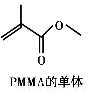
��10�֣�)�л�����(PMMA)�ɷ�Ϊ�ۼ���ϩ��������������Ժá������������۸�������㷺Ӧ������ҵ���Ṥ�������������ȷ��棬�����˹���ĤҲ���л��������䵥��Ľṹ��ҵ�ϳ�·����ͼ��ʾ��

��֪��(1)
(2)R-Br R-OH
R-OH
��ش��������⣺
(1)д��B�й��������� ��PMMA�Ľṹ��ʽ ��
(2)�ж�D��E�ķ�Ӧ���� ��
(3)д��E+F��G�Ļ�ѧ��Ӧ����ʽ ��
(4)д��C��һ����������������ͭ��Ӧ��ͬ���칹�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���Ϻ��о�����������ѧ����ĩ��ѧ������⻯ѧ�Ծ��������棩 ���ͣ������
ú�����к��ж��ַ����廯�������Ҫ�Ļ���ԭ�ϡ���������ú�����Ʊ������屽�����̡�

42.1.�����ٵ������� ���Լ����� ����Ӧ���У�NaHS�� ����
43.2.�����屽��ϵͳ����Ϊ ��
44.3.����������ֱ���廯��ȡ�����屽�������� ��
ָ�������ȱ�������ȡ����Ӧ�Ķ�����ʵ ��
45.4.����������ˮ��Һ�壬�������ԡ��������к������ı����������������ᴿ���� ��
46.5.�������ǻ����������Ƶ����ʣ����������[(CH3CO)2O]��һ�������·�Ӧ����������CH3COOH�⣬���ɵ���һ���л���Ľṹ��ʽΪ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com