
【题目】固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:
CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJmol﹣1
某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).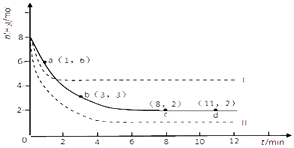
(1)a点正反应速率(填大于、等于或小于)逆反应速率.
(2)下列时间段平均反应速率最小的是 .
A.0~1min
B.1~3min
C.3~8min
D.8~11min
(3)求平衡时氢气的转化率和该条件下反应的平衡常数K.(写出计算过程)
(4)仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是 , 曲线II对应的实验条件改变是 . 判断的理由是
【答案】
(1)大于
(2)D
(3)解:
CO2(g)+ | 3H2(g) | CH3OH(g)+ | H2O(g) | ||
起始物质的量/mol | 6 | 8 | 0 | 0 | |
物质的量变化/mol | 2 | 6 | 2 | 2 | |
平衡物质的量/mol | 4 | 2 | 2 | 2 |
氢气的转化率为: ![]() =
= ![]() =75%,K=
=75%,K= ![]() =
= 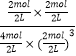 =0.5L2mol﹣2,
=0.5L2mol﹣2,
答:平衡时氢气的转化率为75%,该条件下反应的平衡常数为0.5L2mol﹣2
(4)升高温度;增大压强;Ⅱ中反应速率增大,平衡时氢气物质的量减少,说明平衡正移,该反应正方向为气体分子数目减少,因此改变的条件为增大压强
【解析】解:(1)a点时还没有达到平衡状态,反应物氢气的物质的量继续减小,平衡向正向移动,所以正反应速率大于逆反应速率,所以答案是:大于;(2)分别计算不同时间内的反应速率:0~1min内,v(H2)= ![]() =1mol/(Lmin);1~3min内,v(H2)=
=1mol/(Lmin);1~3min内,v(H2)= ![]() =0.75mol/(Lmin);3~8min内,v(H2)=
=0.75mol/(Lmin);3~8min内,v(H2)= ![]() =0.1mol/(Lmin);8min后达到化学平衡状态,正逆反应速率相等,综合速率为零;所以0~1min内反应速率最大,8~11min反应速率最小,
=0.1mol/(Lmin);8min后达到化学平衡状态,正逆反应速率相等,综合速率为零;所以0~1min内反应速率最大,8~11min反应速率最小,
所以答案是:D;(4)曲线I反应速率增大,但转化的氢气的物质的量少,应是升高温度,因该反应放热,升高温度平衡逆向移动,不利于氢气的转化,故曲线I是升高温度;曲线Ⅲ反应速率增大,转化的氢气的物质的量多,因增大压强平衡正向移动,故应是增大压强.
所以答案是:升高温度;增大压强;Ⅱ中反应速率增大,平衡时氢气物质的量减少,说明平衡正移,该反应正方向为气体分子数目减少,因此改变的条件为增大压强.
【考点精析】通过灵活运用化学平衡的计算,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%即可以解答此题.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在实验室利用浓盐酸和MnO2制氯气,制备装置中应安装分液漏斗而不能使用长颈漏斗,有关理由叙述错误的是()
A.防止氯气扩散到空气中造成污染
B.便于控制加入盐酸的量
C.长颈漏斗不便于添加液体
D.尽量避免HCl挥发到空气中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在常温下一定能大量共存的是( )
A.pH=0的无色溶液中:Cl﹣、Na+、SO ![]() 、Fe2+
、Fe2+
B.在 ![]() ?=1012的溶液中:NH
?=1012的溶液中:NH ![]() 、NO
、NO ![]() 、K+、Cl﹣
、K+、Cl﹣
C.加入铝粉能放出H2的溶液中:Mg2+、NH ![]() 、NO
、NO ![]() 、Cl﹣
、Cl﹣
D.含有大量Fe3+的溶液中:Al3+、SCN﹣、Br﹣、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备苯甲醇和苯甲酸的化学原理是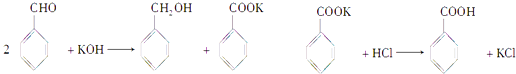
已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3℃;苯甲酸的熔点为121.7℃,沸点为249℃,溶解度为0.34g;乙醚的沸点为34.8℃,难溶于水.制备苯甲醇和苯甲酸的主要过程如下:
苯甲醛 ![]() 白色糊状物
白色糊状物 ![]()
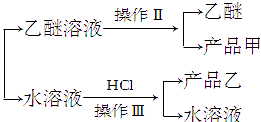
试根据上述信息回答下列问题:
(1)操作Ⅰ的名称是 , 乙醚溶液中所溶主要成分是 .
(2)操作Ⅱ的名称是 , 产品甲是 .
(3)操作Ⅲ的名称是 , 产品乙是 .
(4)如图所示,操作Ⅱ中温度计水银球上沿放置的位置应是(填“a”、“b”、“c”或“d”),该操作中,除需蒸馏烧瓶、温度计外,还需要的玻璃仪器是 , 收集产品乙醚的适宜温度为 . 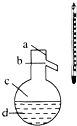
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上炼铁的主要反应为:Fe2O3 + 3CO![]() 2Fe + 3CO2 。
2Fe + 3CO2 。
(1)该反应中氧化剂是______(填化学式),判断依据是________;被氧化的物质是____(填化学式);若反应中消耗了3 mol CO,则生成______mol Fe。
(2)理论上来看,其中CO可用以下______组(选填a、b、c)物质代替,这些物质在反应中的作用都是_______。
a组: H2 、Cl2 、C b组: H2 、Al、C c组:C 、Al、 Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是
A. 分液、蒸馏、萃取 B. 萃取、蒸馏、分液
C. 分液、萃取、蒸馏 D. 蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,用等物质的量的A和B发生如下反应:A(g)+2B(g)2C(g),反应达平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为( )
A.40%
B.50%
C.60%
D.70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是一种重要的化工产品,硫酸的消耗量常被视为一个国家工业发展水平的一种标志.目前的重要生产方法是“接触法”,有关接触氧化反应2SO2+O2 ![]() 2SO3 , 的说法不正确的是( )
2SO3 , 的说法不正确的是( )
A.该反应为可逆反应,故在一定条件下二氧化硫和氧气不可能全部转化为三氧化硫
B.达到平衡后,反应就停止了,故此时正、逆反应速率相等且均为零
C.一定条件下,向某密闭容器中加入2molSO2和1molO2 , 则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等
D.在利用上述反应生产三氧化硫时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com