
分析 (1)根据元素守恒知,A中含有Cu元素,该反应中I元素化合价由-1价变为0价,Cu元素得电子化合价降低,白色沉淀是Cu和I元素形成的化合物,n(CuSO4)=$\frac{16.0g}{160g/mol}$=0.1mol,m(Cu)=64g/mol×0.1mol=6.4g,A中n(I)=$\frac{19.1g-6.4g}{127g/mol}$=0.1mol,n(Cu):n(I)=0.1mol:0.1mol=1:1,据此判断A化学式;
碘酸根离子和亚硫酸根离子发生氧化还原反应生成硫酸根离子、碘、氢离子和水;
(2)根据水的电离方程式确定IF5电离方程式,从而确定其阴离子;
(3)AlI3属于强酸弱碱盐、Na2CO3属于强碱弱酸盐,二者发生双水解反应生成氢氧化铝和二氧化碳;
(4)①碘离子具有还原性、碘酸根离子具有强氧化性,试样加酸酸化,如果加淀粉溶液后试样溶液变蓝,说明有碘单质生成,则存在碘离子和碘酸根离子;
②试样酸化后,然后向溶液中加入氧化剂,如果加入淀粉溶液后试样溶液变蓝,说明试样中存在I-;
③试样酸化后,如果直接使淀粉碘化钾试纸变蓝色,就说明含有碘酸根离子.
解答 解:(1)根据元素守恒知,A中含有Cu元素,该反应中I元素化合价由-1价变为0价,Cu元素得电子化合价降低,白色沉淀是Cu和I元素形成的化合物,n(CuSO4)=$\frac{16.0g}{160g/mol}$=0.1mol,m(Cu)=64g/mol×0.1mol=6.4g,A中n(I)=$\frac{19.1g-6.4g}{127g/mol}$=0.1mol,n(Cu):n(I)=0.1mol:0.1mol=1:1,则A化学式为CuI;
碘酸根离子和亚硫酸根离子发生氧化还原反应生成硫酸根离子、碘、氢离子和水,离子方程式为2IO3-+5HSO3-=3H++5SO42-+I2+H2O,
故答案为:CuI;2IO3-+5HSO3-=3H++5SO42-+I2+H2O;
(2)根据水的电离方程式知,IF5电离方程式为2IF5?IF4++IF6-,所以阴离子为IF6-,
故答案为:IF6-;
(3)AlI3属于强酸弱碱盐、Na2CO3属于强碱弱酸盐,二者发生双水解反应生成氢氧化铝和二氧化碳,离子方程式为2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑,
故答案为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;
(4)①碘离子具有还原性、碘酸根离子具有强氧化性,试样加酸酸化,如果加淀粉溶液后试样溶液变蓝,说明有碘单质生成,则存在碘离子和碘酸根离子,离子反应方程式为5I-+IO3-+6H+=3I2+3H2O,故答案为:5I-+IO3-+6H+=3I2+3H2O;
②试样酸化后,然后向溶液中加入氧化剂,如FeCl3(或H2O2),如果加入淀粉溶液后试样溶液变蓝,说明试样中存在I-,
故答案为:FeCl3(或H2O2);
③试样酸化后,如果直接使淀粉碘化钾试纸变蓝色,则碘离子被氧化生成碘单质,就说明原溶液含有碘酸根离子,
故答案为:淀粉-KI.
点评 本题考查性质实验方案设计,题目难度中等,涉及离子检验、双水解反应、弱电解质的电离等知识点,明确物质性质是解本题关键,会利用已知知识采用知识迁移方法解答问题.


科目:高中化学 来源: 题型:解答题
 A、B、C、D、E是原子序数依次递减的五种常见元素.C元素是地壳中含量最多的元素,D、E组成的气态化合物M的水溶液呈碱性,B的单质在C2中燃烧产物可使品红溶液褪色,A是一种历史悠久、应用广泛的金属元素.请回答:
A、B、C、D、E是原子序数依次递减的五种常见元素.C元素是地壳中含量最多的元素,D、E组成的气态化合物M的水溶液呈碱性,B的单质在C2中燃烧产物可使品红溶液褪色,A是一种历史悠久、应用广泛的金属元素.请回答: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH3+Cl2 $\stackrel{光照}{→}$CH3CH2Cl+HCl | |
| B. | CH2═CH2+HBr→CH3CH2Br | |
| C. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | |
| D. | CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$H3COOCH2CH3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮气的电子式: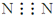 | |
| B. | 乙酸乙酯的结构简式:C4H8O2 | |
| C. | O2-的结构示意图: | |
| D. | 氢氧化钡的电离方程式:Ba(OH)2═Ba2++(OH-)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,1.0L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 1molCu和足量热浓硫酸反应可生成NA个SO3分子 | |
| C. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 18gD2O和18gH2O中含有的质子数均为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +4 | B. | +5 | C. | +6 | D. | +7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com