
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:选择题
| A. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| B. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸 | |
| C. | 酒精灯着火时可用湿布扑灭 | |
| D. | 蒸馏时,温度计水银球应浸没在液体中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上常使用过量的空气,目的是为了使SO2的转化率达100% | |
| B. | 工业上选用V2O5作该反应的催化剂,目的是为了加快化学反应速率 | |
| C. | 工业上常选用常压,原因是增大压强不能改变该反应的化学反应速率 | |
| D. | 升高温度可以加快反应速率,所以在工业生产中该反应温度越高越好 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
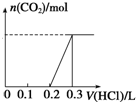 100mL 1mol•L-1烧碱溶液中通入一定量CO2充分反应后,将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,
100mL 1mol•L-1烧碱溶液中通入一定量CO2充分反应后,将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuCl2 | B. | FeCl2 | C. | FeCl3 | D. | AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com