
【题目】根据问题填空:
(1)氟化氢水溶液中存在的氢键有种;分子(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子最外层均满足8电子稳定结构,其结构式为 , 1个分子中含有个π键;
(2)金属镍及其化合物在合金材料以及催化剂等方面应用广泛,NiO的晶体结构类型与氯化钠的相同,NiO晶胞中Ni和O的配位数均为;很多不饱和有机物在Ni催化下可以H2发生加成反应,如①CH2=CH2、②HC≡CH、③ ![]() 、④HCHO等,其中碳原子不是采取sp2杂化的分子有(填物质编号),HCHO分子的立体构型为 .
、④HCHO等,其中碳原子不是采取sp2杂化的分子有(填物质编号),HCHO分子的立体构型为 .
【答案】
(1)4; N≡C﹣C≡N;4
(2)6;②;平面三角形
【解析】解:(1)HF分子之间形成氢键,水分子之间形成氢键,HF与水分子之间形成2种氢键(H﹣F…H﹣O、H﹣O…H﹣F),氟化氢水溶液中存在的氢键有4种氢键;分子(CN)2中碳原子按sp杂化,碳碳之间是单键,碳氮之间是参键,其结构式为:N≡C﹣C≡N,碳氮参键中有两个π键,所以1个分子中含有4个π键,
所以答案是:4;N≡C﹣C≡N;4;(2)NiO的晶体结构类型与氯化钠相同,氯化钠中钠离子和氯离子配位数都是6,所以NiO中Ni和O的配位数都是6,
①CH2=CH2中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故①正确;
②HC≡CH中每个碳原子含有2个σ键,不含孤电子对,所以采取sp杂化,故②错误;
③ ![]() 中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故③正确;
中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故③正确;
④HCHO中碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故④正确;
HCHO中碳原子含有3个σ键,不含孤电子对,所以其空间构型是平面三角形,
所以答案是:6;②;平面三角形.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是( ) 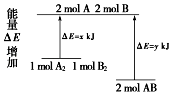
A.该反应的反应热△H=x﹣y kJ/mol
B.断裂1 mol A﹣A键和1 mol B﹣B键放出x kJ能量
C.2 mol AB的总能量高于1 mol A2和1 mol B2总能量
D.该反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下列空格。
(1)已知拆开1molH-H键、1molCl-Cl键、1molH-Cl键分别需要吸收的能量为436.4kJ、242.7kJ、431.8kJ。则由H2和Cl2反应生成1molHCl需要_____(填“放出”或“吸收”)____kJ的热量。
(2)H2可以在Cl2中安静地燃烧。甲、乙两图中,能表示该反应能量变化的是图_____(填“甲”或“乙”)。

(3)已知:H2与Cl2在光照条件下会发生爆炸。同温同压下,反应H2(g)+Cl2(g)=2HCl(g)。在光照和点燃条件下的H_____(填“相等”或“不相等”)。
(4)硅、磷、硫、氯元素的气态氢化物的形成条件和热稳定性如下表所示:
元素符号 | Si | P | S | Cl |
单质与氢气的反应 | 高温下反应 | 磷蒸气与氢气能反应 | 加热时反应 | 光照或点燃时发生爆炸而化合 |
气态氢化物的热稳定性 | 不稳定 | 不稳定 | 受热分解 | 稳定 |
结合元素原子结构等知识,分析以上信息可得出的结论是:同周期非金属元素,随着元素核电荷数的递增,____________________________________,因此,Si、P、S、Cl非金属性依次增强。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一温度下,某一密闭容器中,M、N、R三种气体浓度的变化如图a所示,若其它条件不变,当温度分别为T1和T2时,N的体积分数与时间关系如图b所示.则下列结论正确的是( ) 
A.该反应的热化学方程式M(g)+3N(g)2R(g)△H>0
B.达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动
C.达到平衡后,若其它条件不变,升高温度,正、逆反应速度均增大,M的转化率减小
D.达到平衡后,若其他条件不变,通入稀有气体,平衡一定向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.水导电性很差,所以水是非电解质
B.电解质与非电解质的本质区别,是在一定条件下自身能否电离
C.酸、碱和盐类都属于电解质,其他化合物一定都是非电解质
D.NaCl和HCl都是电解质,所以它们熔融状态下都能导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国的矿产资源丰富。利用某冶炼废渣(主要成分为二氧化硅和锡、铜、铅、铁的氧化物)回收锡、铜、铅的工艺流程如下图所示:

回答下列问题:
(1)电炉冶炼时,焦炭的作用是________(填“氧化剂”或“还原剂”),将焦炭粉碎的目的是__________。熔剂的主要成分是氟石(CaF2),高温下能与SiO2反应生成两种钙盐,其中之一为 CaSiF6,该反应的化学方程式为____________________________。![]()
(2)脱铁后的溶液中含有少量的Sn2+,为减少锡的损失,可用锡、铜、铅、铁多元合金回收处理,反应的离子方程式为____________________________。
(3)已知SnO2不溶于稀硫酸。脱铁后氧化焙烧的目的是__________________。
(4)电解CuSO4溶液时,阳极的电极反应式为___________________________。
(5)已知H2CO3的一、二级电离常数分别为K1、K2,PbSO4、PbCO3的溶度积常数分别为Ksp(PbSO4)、Ksp(PbCO3)。锡、铅渣中的铅主要以PbSO4存在,脱硫时发生的反应为:
PbSO4(s)+HCO3ˉ(aq) ![]() PbCO3(s)+H+(aq)+SO42-(aq),该反应的平衡常数K=___________(用上述已知常数表示)。脱硫后需过滤、洗涤再进入下一步工序,检验滤渣是否洗涤干净的方法是_____________________________。
PbCO3(s)+H+(aq)+SO42-(aq),该反应的平衡常数K=___________(用上述已知常数表示)。脱硫后需过滤、洗涤再进入下一步工序,检验滤渣是否洗涤干净的方法是_____________________________。
(6)若该冶炼废渣中锡的质量分数为5%,30t废渣制得精锡lt,则锡的回收率为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所发生的反应中,属于酯化反应的是( )
A. 实验室用乙醇、乙酸和浓硫酸反应 B. 将苯滴入溴水中,振荡后水层接近无色
C. 乙烯使酸性高锰酸钾溶液褪色 D. 甲烷与氯气混合,黄绿色消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油产品中除含有H2S外,还含有各种形态的有机硫,如COS、CH3SH等。
回答下列问题:
(1)CH3SH(甲硫醇)的电子式为__________。
(2)CO和H2S反应可产生羰基硫( COS)。在一恒容密闭容器中发生反应:CO(g)+H2S(g)![]() COS(g)+H2(g)并达到平衡,数据如下表所示:
COS(g)+H2(g)并达到平衡,数据如下表所示:
实验 | 温度/℃ | 起始时 | 平衡时 | |||
n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | a |
3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
①该反应是________反应(填“吸热”或“放热”)。
②实验1达平衡时,CO的转化率为_______。
③实验2达到平衡时,a_______7.0(填“大于”“小于”或“等于”)。
④实验3达平衡后,再充入1.0 molH2,平衡常数值____(填“增大”“减小”或“不变”)。
(3)COS是大气污染物。在酸性溶液中可用H2O2氧化COS生成一种强酸脱硫。该脱除反应的化学方程式为_______________。
(4)有一种脱硫工艺为:真空K2CO3一克劳斯法。
①K2CO3溶液吸收H2S的反应为K2CO3 +H2S =KHS +KHCO3,该反应的平衡常数的对数值为lgK=_____(已知:H2CO3 lgK1=-6.4,lgK,2=- 10.3;H2S lgKl=-7.0,lgK
②已知下列热化学方程式:
a. 2H2S(g)+3O2(g)=2SO2(g)+2H2O(1) △H1=-1172kJ/mol
b. 2H2S(g)+O2(g)=2S(s)+2H2O(1) △H2 = 632 kJ/mol
克劳斯法回收硫的反应为SO2和H2S气体反应生成S(s),则该反应的热化学方程式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com