
| A. | 热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(g)△H=-1256kJ/mol,表示乙炔的燃烧热为1256kJ/mol | |
| B. | -OH与OH-组成元素相同,含有的电子数也相同 | |
| C. | H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ/mol,表示含1molNaOH的氢氧化钠溶液与含0.5mol H2SO4的浓硫酸混合后放出57.3 kJ的热量 | |
| D. | 中和热测定实验中,不能用铜丝搅拌棒代替环形玻璃搅拌棒 |
分析 A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,而水蒸气不是稳定氧化物;
B.羟基含有9个电子,而氢氧根离子含有10个电子;
C.浓硫酸溶于水放热,则含0.5mol H2SO4的浓硫酸与1mol氢氧化钠溶液反应后放出热量大于57.3 kJ;
D.中和热测定中,必须尽量减少热量散失,结合铜丝搅拌棒导热分析.
解答 解:A.该热化学方程式中生成的水为气态,而液态水更稳定,所以乙炔的燃烧热不是1256kJ/mol,故A错误;
B.-OH与OH-组成元素相同,二者含有的电子数分别为9、10,则含有的电子数不相同,故B错误;
C.H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ/mol表示稀的强酸与稀的强碱溶液的反应,而浓硫酸溶于水放热,导致放出热量偏高,即含0.5mol H2SO4的浓硫酸与1mol氢氧化钠溶液反应后放出热量大于57.3 kJ,故C错误;
D.中和热测定实验中,为了减小误差,应该尽量减少热量散失,所以不能用铜丝搅拌棒代替环形玻璃搅拌棒,故D正确;
故选D.
点评 本题考查较为综合,涉及热化学方程式的应用、中和热、燃烧热的概念、原子构成及中和热测定等知识,明确燃烧热、中和热的概念为解答关键,注意掌握热化学方程式的书写原则及表示意义,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:实验题
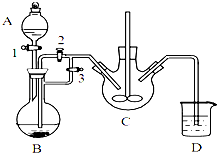 乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe•3H2O+CO2↑.
乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe•3H2O+CO2↑.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原产物为NH4+ | |
| B. | 若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+ | |
| C. | Fe3+和Fe2+分别属于反应物和生成物 | |
| D. | 氧化剂与还原剂的物质的量之比为1:8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com