
分析 X原子核外的M层中只有两对成对电子,核外电子排布应为1s22s22p63s23p4,则X为S元素;Y原子核外的L层电子数是K层的两倍,Y有2个电子层,最外层电子数为4,则Y为C元素;Z是地壳内含量最高的元素,则Z为O元素;Q的核电荷数是X与Z的核电荷数之和,Q的原子序数=16+8=24,则Q为Cr元素;E在元素周期表的各元素中电负性最大,则E应为F元素,结合元素对应单质、化合物的结构和性质解答该题.
解答 解:X原子核外的M层中只有两对成对电子,核外电子排布应为1s22s22p63s23p4,则X为S元素;Y原子核外的L层电子数是K层的两倍,Y有2个电子层,最外层电子数为4,则Y为C元素;Z是地壳内含量最高的元素,则Z为O元素;Q的核电荷数是X与Z的核电荷数之和,Q的原子序数=16+8=24,则Q为Cr元素;E在元素周期表的各元素中电负性最大,则E应为F元素,
(1)根据分析可知,X、E的元素符号分别为S、F,
故答案为:S;F;
(2)XZ2为SO2,SO2分子中S和O形成2个δ键,有1个孤电子对,为V形,YZ2为CO2中,CO2分子中C和O形成2个δ键,没有孤电子对,为直线形;SO2是极性分子,而CO2是非极性分子,而溶剂H2O是极性分子,根据相似相溶原理可知SO2在水中溶解度更大,
故答案为:V形;直线形;SO2;
(3)Q为Cr,原子序数为24,位于周期表第四周期ⅥB族,其核外电子排布式为:1s22s22p63s23p63d54s1,Cr的最高化合价为+6价,
故答案为:1s22s22p63s23p63d54s1;+6.
点评 本题考查原子结构与元素的性质,题目难度中等,注意把握原子核外电子排布,推断元素的种类是关键,还要注意把握分析空间构型的判断,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
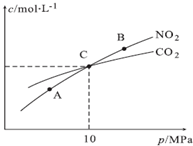 氮的化合物在生产生活中广泛存在.
氮的化合物在生产生活中广泛存在. .可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如表所示(假定不同物质中同种化学键的键能一样),则上述反应的△H=+11.3kJ•mol-1.
.可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如表所示(假定不同物质中同种化学键的键能一样),则上述反应的△H=+11.3kJ•mol-1.| 化学键 | 键能/(kJ•mol-1) |
| N-H | 391.3 |
| Cl-Cl | 243.0 |
| N-Cl | 191.2 |
| H-Cl | 431.8 |
| t/min | 0 | 40 | 80 | 120 | 160 |
| n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
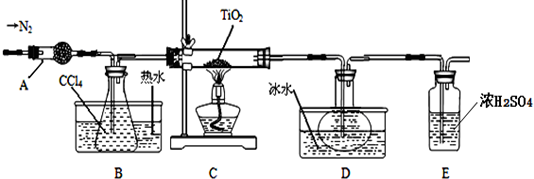
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化合物 | 密度(g•cm-3) | 水溶性 | 沸点(℃) |
| 冰乙酸 | 1.05 | 易溶 | 118.1 |
| 正丁醇 | 0.80 | 微溶 | 117.2 |
| 正丁醚 | 0.77 | 不溶 | 142.0 |
| 乙酸正丁酯 | 0.90 | 微溶 | 126.5 |


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NO2═O2+2NO;△H=+116.2kJ/mol(燃烧热) | |
| B. | 2S(s)+2O2(g)═2SO2(g);△H=-269.8kJ/mol(燃烧热) | |
| C. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-57.3kJ/mol(中和热) | |
| D. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(g)△H=-1256kJ/mol,表示乙炔的燃烧热为1256kJ/mol | |
| B. | -OH与OH-组成元素相同,含有的电子数也相同 | |
| C. | H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ/mol,表示含1molNaOH的氢氧化钠溶液与含0.5mol H2SO4的浓硫酸混合后放出57.3 kJ的热量 | |
| D. | 中和热测定实验中,不能用铜丝搅拌棒代替环形玻璃搅拌棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
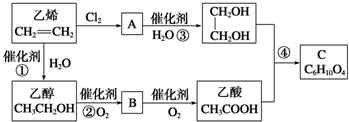
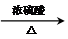 CH3COOCH2-CH2OOCCH3+2H2O.
CH3COOCH2-CH2OOCCH3+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com