
【题目】糖类、油脂、蛋白质是重要的营养物质,下列说法正确的是( )
A.棉、麻、蚕丝都是纤维素B.油脂为混合物
C.1 mol 蔗糖完全水解可得 2 mol 葡萄糖D.遇 Pb2+凝固后的鸡蛋清可溶于蒸馏水
科目:高中化学 来源: 题型:
【题目】化合物I(C9H12O2)是合成某功能高分子材料的中间体,由C2H4和![]() 合成的路线如图所示:
合成的路线如图所示:

已知:i、RCHO+CH3CHO![]() RCH=CHCHO+H2O(R为代表烃基或氢原子)
RCH=CHCHO+H2O(R为代表烃基或氢原子)
ii、![]()
回答下列问题:
(1)试剂X的名称______________________。
(2)E的结构简式为______________________。
(3)反应④的类型是______________________。
(4)D中所含的官能团名称是______________________。
(5)写出反应⑤的化学方程式:_________________________________。
(6)同时符合下列条件的I的同分异构体共有___________种(不考虑立体异构),其中核磁共振氢谱图表明分子中有5种氢原子的为___________(写1种结构简式)。a.分子中含有苯环且苯环上有三个取代基;b.1mol有机物最多能消耗2 mol NaOH。
(7)设计以乙醛和1,3-丁二烯(CH2=CHCH=CH2)为原料制备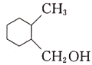 的合成路线:________ (用流程图表示,无机试剂任选)。
的合成路线:________ (用流程图表示,无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素包括氯、溴、碘等元素,其中溴和碘在陆地上含量极少,主要存在于海水中。
(1)氯气有毒,一旦泄露会造成对空气的严重污染。工业上常用浓氨水检验氯气管是否漏气。(已知Cl2可将NH3氧化成N2)写出有关的化学方程式_________________________________。
(2)亚氯酸钠(NaClO2)是一种漂白剂。 已知NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量相同,从电子守恒的角度解释其原因是_________________________________________。
(3)从海水中提取溴,一般要经过浓缩、氧化和提取三个步骤。氧化时常用氯气做氧化剂,写出有关的离子方程式___________________________________________________________。海带提碘时,由于碘的量较少,在灼烧、溶解之后得到的溶液用硝酸银溶液很难检验。设计一个检验溶液中是否含有碘离子的方法_________________________________________。
(4)盐酸和醋酿都是一元酸,某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,平衡pH随溶液体积变化的曲线如下图所示。据图判断盐酸稀释时的pH变化曲线为___________ (填“I”或“II”),溶液的导电性b ___________ c(填“>”、“<”或“=”)。水电离的c(H+)a点比b点大还是小?从电离平衡移动原理解释原因________________________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是
A. pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5mol·L—1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D. pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在体积为5 L的密闭容器中发生可逆反应。(Ⅰ)若某可逆反应的化学平衡常数表达式为:K=![]()
(1)写出该反应的化学方程式:
(2)能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
A.容器中气体的平均相对分子质量不随时间而变化
B.v正(H2O)=v逆(H2)
C.容器中气体的密度不随时间而变化
D.容器中总质量不随时间而变化
E.消耗n mol H2的同时消耗n mol CO
(Ⅱ)若该密闭容器中加入的是2 mol Fe(s)与1 mol H2O(g),t1秒时,H2的物质的量为0.20 mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.35 mol。
(1)t1~t2这段时间内的化学反应速率v(H2)= 。
(2)若继续加入2 mol Fe(s),则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”),继续通入1 mol H2O(g),再次达到平衡后,H2物质的量为 mol。
(3)该反应的逆反应速率随时间变化的关系如图。t1时改变了某种条件,改变的条件可能是 、 (填写2项)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。
I. K2Cr2O7曾用于检测司机是否酒后驾驶:
Cr2O72-(橙色)+CH3CH2OH![]() Cr3+(绿色)+CH3COOH (未配平)
Cr3+(绿色)+CH3COOH (未配平)
(1)基态Cr 原子的价电子轨道表达式为_________________。
(2)CH3COOH分子中所含元素的电负性由大到小的顺序为___________,碳原子的轨道杂化类型为_________,所含σ键与π键的数目之比为______________________。
(3)已知Cr3+等过渡元素水合离子的颜色如下表所示:
离子 | Se3+ | Cr3+ | Fe2+ | Zn2+ |
水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Se3+、Zn2+的水合离子为无色的原因为_______________________。
II. ZnCl2浓溶液常用于除去金属表面的氧化物,例如与FeO反应可得Fe[Zn(OH)Cl2]2溶液。
(4) Fe[Zn(OH)Cl2]2溶液中不存在的微粒间作用力有________(填选项字母);
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力 F.氢键
溶液中[Zn(OH)Cl2]-的结构式为_____________________。
III.锌是人体必需的微量元素之一,其堆积方式如图1,晶胞结构如图2。

(5)锌的堆积方式为_________,配位数为__________________。
(6)若梓原子的半径为a pm,阿伏加德罗常数的值为NA,则锌晶体的密度为______g/㎝3 (用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物,下列框图是分离操作步骤流程图:

则试剂a是________,分离方法Ⅰ是________,分离方法Ⅱ是________,试剂b是________,分离方法Ⅲ是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗菌作用的白头翁素衍生物H的合成路线如下图所示:

已知:
i.RCH2Br ![]() RHC=CH=R’
RHC=CH=R’
ii.RHC=CH=R’
iii.RHC=CH=R’ 
(1)A属于芳香烃,其名称是________________。
(2)B的结构简式是__________________。
(3)由C生成D的化学方程式是______________________________________________。
(4)由G生成H的反应类型是________,1molF与足量NaOH溶液反应,消耗______mol NaOH。
(5)试剂b是_______________。
(6)下列说法正确的是____(选填字母序号).
a.G存在顺反异构体
b.由G生成H的反应是加成反应
c. 1mol G最多可以与1mol H2发生加成反应
d. 1mol F或1mol H与足量NaOH溶液反应,均消耗2molNaOH
(7)以乙烯为起始原料,结合已知信息选用必要的无机试剂合成 ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)___________________。
,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A.酒精和四氯化碳可以用水加以鉴别
B.根据蛋白质在火焰上燃烧产生的气味,确定该物质是蛋白质还是植物纤维
C.用焰色反应鉴别K2SO4和KCl两种粉末
D.用澄清石灰水检验CO中混有的CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com