
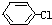
 +NaOH→
+NaOH→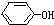 +NaCl,该反应的反应类型属于( )
+NaCl,该反应的反应类型属于( )| A. | 加成反应 | B. | 取代反应 | C. | 氧化还原反应 | D. | 置换反应 |
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:多选题
| A. | 饱和纯碱(Na2CO3)溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | 1mol/L的(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| C. | 0.10mol/L醋酸钠溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | |
| D. | 等体积,pH=3的盐酸和醋酸中和氢氧化钠的物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B2A2和B2A中阴阳离子的个数比相同 | |
| B. | 原子半径的大小顺序:r(D)>r(C)>r(B)>r(A) | |
| C. | D的简单气态氢化物的热稳定性比A的强 | |
| D. | 元素C的单质是一种高硬度、高熔点的金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
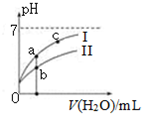 已知:下表为25℃时某些弱酸的电离平衡常数.
已知:下表为25℃时某些弱酸的电离平衡常数.| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7Ka2=4.7×10-11 |
| A. | 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:ClO-+CO2+H2O=HClO+CO32- | |
| C. | 图象中a、c两点处的溶液中$\frac{c({R}^{-})}{c(HR)•c(O{H}^{-})}$相等(HR代表CH3COOH或HClO) | |
| D. | 图象中a点酸的总浓度大于b点酸的总浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是一种重要的化工原料.
甲醇是一种重要的化工原料.| CO2%-CO%-H2% (体积分数) | 0-30-70 | 2-28-70 | 4-26-70 | 8-22-70 | ||||||||
| 反应温度/℃ | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 |
| 生成CH3OH的碳转化率(%) | 4.9 | 8.8 | 11.0 | 36.5 | 50.7 | 68.3 | 19.0 | 33.1 | 56.5 | 17.7 | 33.4 | 54.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;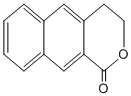 是一种重要的药物合成中间体,请结合题目所给信息,
是一种重要的药物合成中间体,请结合题目所给信息,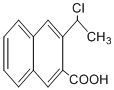 为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下: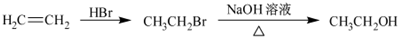
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com