
| 选项 | 改变的条件 | 结论 |
| A | 升温 | CO32-的水解平衡向右移动 |
| B | 加入AlCl3固体 | 产生大量气体 |
| C | 加入100mLH2O | 溶液中c(H+)、c(OH-)均减小 |
| D | 加入少量CH3COONa固体 | 溶液中n(CO32-)增大 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、盐类的水解吸热;
B、CO32-和Al3+能发生双水解;
C、加水稀释,碳酸根的水解被促进;
D、CH3COONa水解显碱性,能抑制碳酸根的水解.
解答 解:A、盐类的水解吸热,故升高温度,CO32-的水解平衡右移,故A正确;
B、CO32-和Al3+能发生双水解,故向碳酸钠溶液中加入氯化铝溶液后,生成二氧化碳气体,故B正确;
C、加水稀释,碳酸根的水解被促进,故溶液中的c(OH-)减少,而水的离子积Kw不变,故c(H+)增大,故C错误;
D、CH3COONa水解显碱性,故和碳酸根的水解相互抑制,故碳酸根的水解平衡左移,则n(CO32-)增大,故D正确.
故选C.
点评 本题考查了影响盐类水解的因素,难度不大,应注意的是同类离子之间的水解相互抑制.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:实验题
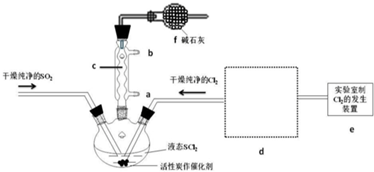
| 方案 | 甲 | 乙 | 丙 | 丁 |
| 发生装置 |  |  |  |  |
| 所选试剂 | NaHSO3固体 | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO3 | 70%H2SO4+K2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol NO的质量是30g | |
| B. | 标准状况下,1 mol H2O的体积是22.4 L | |
| C. | 17 g NH3含有的氢原子总数为6.02×1023 | |
| D. | 0.1 mol Na2CO3中,Na+的物质的量为 0.1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
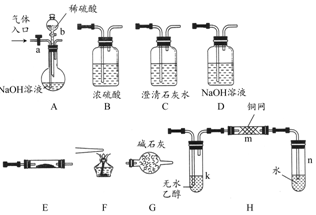 如图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择).
如图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
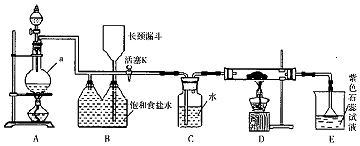
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
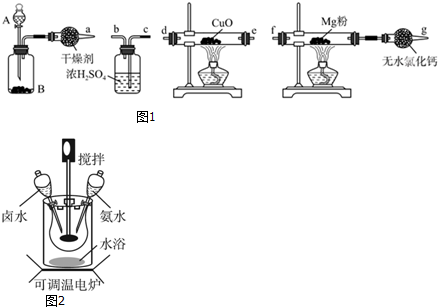
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
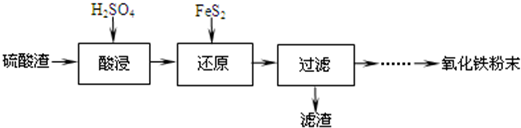
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com