
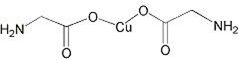
 锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:分析 (1)根据Cu原子序数,写出其核外电子排布式;根据其最外层电子数判断;同一周期中,元素的电负性随着原子序数的增大而增大,同主族自上而下电负性降低,非金属性越强电负性越强;
(2)原子数和价电子数均相同的微粒互为等电子体;
(3)根据氮原子的成键情况判断氮原子的杂化方式,氮原子价层电子对个数是4,价层电子对个数=σ键个数+孤电子对个数.
解答 解:(1)Cu是29号元素,其基态Cu2+的核外电子排布式为:1s22s22p63s23p63d104s1,则M层的电子排布式为:3s23p63d10;
Cu最外层电子数为1,与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有K、Cr;
同一周期中,元素的电负性随着原子序数的增大而增大,所以电负性大小顺序为:N<O,同一主族,元素的电负性随着原子序数的增大而减小,S<O;非金属性越强电负性越强,H<S<N,所以电负性由小到大的顺序为 H<S<N<O;
故答案为:3s23p63d10;K、Cr; H<S<N<O;
(2)原子数和价电子数均相同的微粒互为等电子体,PO43-的等电子体为CCl4、SO42-;
故答案为:CCl4、SO42-;
(3)氮原子价层电子对个数=3+$\frac{1}{2}$(5-3×1)=4,氮的杂化方式为sp3杂化;
故答案为:sp3.
点评 本题考查了核外电子排布、电负性、杂化方式、等电子体等内容,题目综合性强,难度中等,注意把握电子排布式的书写方法,侧重于考查学生对基础知识的应用能力.


科目:高中化学 来源: 题型:选择题
| A. | ①②④⑥ | B. | ②③⑤ | C. | ①②⑤⑥ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
; +HBr→
+HBr→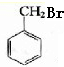 +H2O、
+H2O、 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2溶液 | B. | AgNO3溶液 | C. | H2SO4溶液 | D. | 稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题:
某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.04 |
| 2 | 25.00 | 2.00 | 22.00 |
| 3 | 25.00 | 0.20 | 20.21 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
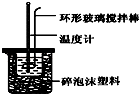 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:| 实验次数 | 起始温度t1/℃ | 起始温度t1/℃ | 终止温度t2/℃ |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

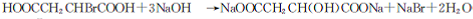 .
. +(n-1)H2O→n HOOCCH2CH(OH)COOH.
+(n-1)H2O→n HOOCCH2CH(OH)COOH.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com