
| A��������������Һ�ζ�ʳ�ף���ʼʱ��Һ��pHͨ���仯���������ӽ���ȫ��Ӧʱ�����ζ��յ㣩��pH����ͻ�䣬��Ϊ�ζ�ͻԾ�� |
| B������ر�����Һ��ȴδ���ֽᾧʱ�������ò��������ĥ������ڴ�ʹ���������� |
| C������װ���ɲ���©��������ƿ����ȫƿ�������õ�������ɣ���������Ҫԭ���dz����ø�����ƿ��ѹ������װ���ڲ���ѹǿ���ͣ�ʹ���˵��ٶȼӿ졣 |
D��Cu2���������ˮ��Ӧ��ȡCu(OH)2�����ӷ���ʽΪ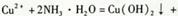 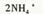 |


 ������ӱ������ͯ������ϵ�д�
������ӱ������ͯ������ϵ�д� A�ӽ��� ϵ�д�
A�ӽ��� ϵ�д� ȫ�Ų��Ծ�ϵ�д�
ȫ�Ų��Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������̫��������ȼ�� | B���ü����������湫���� |
| C�����ó�ϫ�ܷ��� | D���ý��ܵƴ���׳�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 �����������ܶȻ�
�����������ܶȻ� (CH3COOAg )=1.6��10
(CH3COOAg )=1.6��10 ,
, (Ag2CO3)="8.3"
(Ag2CO3)="8.3" 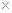 l0
l0 ���ڲ���������ˮ�������£������й�˵����ȷ����
���ڲ���������ˮ�������£������й�˵����ȷ����A������ˮ��Һ�� ���䣬�ʴ����ˮ�ĵ�����Ӱ�� ���䣬�ʴ����ˮ�ĵ�����Ӱ�� |
| B�����¶��±��ʹ���ˮ��Һ��pH =5-lgl.8 |
C�����¶���Ũ�Ⱦ�Ϊ0.01 mol ��CH3COONa��Һ��AgNO3����Һ�������ϣ������Һ������мӺ��ԣ�����CH3COOAg�������� ��CH3COONa��Һ��AgNO3����Һ�������ϣ������Һ������мӺ��ԣ�����CH3COOAg�������� |
D����0.02 mol ��Na2CO3����Һ��CH3COOAg��������Һ�������ϣ����ְ�ɫ���� ��Na2CO3����Һ��CH3COOAg��������Һ�������ϣ����ְ�ɫ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������Һ�м�ˮϡ����10 L |
| B������һ������NaOH���� |
| C������һ����pH��8��NaOH��Һ |
| D������һ��Ũ�ȵ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��a��7ʱ,ˮ�ĵ���һ���ܵ��ٽ� |
| B��a��7ʱ,ˮ�ĵ���һ���ܵ����� |
| C��a��7ʱ,��Һ��pHΪa��14-a |
| D��a��7ʱ,��Һ��pHһ��Ϊa |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
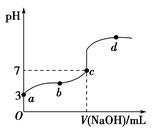
| A��a���ʾ����Һ����ˮ�������H��Ũ��Ϊ1.0��10��11 mol��L��1 |
| B��b���ʾ����Һ��c(CH3COO��)>c(Na��) |
| C��c���ʾCH3COOH��NaOHǡ�÷�Ӧ��ȫ |
D��b��d���ʾ����Һ�� ��� ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
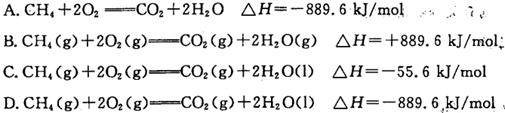
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��c(CH3COO-)<c(Na+) |
| B��c(CH3COOH)+c(CH3COO-)="0.02" mol/L |
| C��c(CH3COOH)>c(CH3COO-) |
| D��c(OH-)+c(CH3COO-)=c(H+)+c(Na+) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����Һ�е������ӵ���Ŀ���ӣ���������ǿ |
| B������ĵ���̶�����[H��]��С |
| C���ټ���10mL pH="11" NaOH��Һ�����ҺpH=7 |
| D����Һ����ˮ�������[H+]=1��10-11 mol/L |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com