
【题目】已知咖啡酸的结构如图所示:
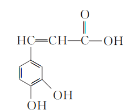
(1)咖啡酸属于__(填“无机化合物”或“有机化合物”)。
(2)咖啡酸中含氧官能团有羟基和__(填名称)。
(3)向咖啡酸溶液中滴加NaHCO3溶液,实验现象为__。
(4)咖啡酸溶液能使酸性高锰酸钾溶液褪色,说明咖啡酸具有__性。
科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其电极a常用掺有石墨烯的S8材料,电极反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法正确的是
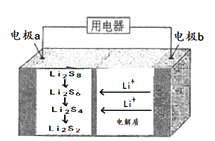
A. 电池工作时,外电路中流过0.02mol电子,负极材料减重0.14g
B. 电解池中加入少量硫酸增强导电性
C. 电池充电时间越长,电池中的Li2S2量越多
D. 电池工作时,负极可发生反应: 2Li2S6+2Li++2e-=3Li2S4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃时,浓度均为 0.10molL﹣1 的氨水和 NH4 Cl 溶液
①NH4 Cl 溶液显________性,原因是(用离子方程式表示)________,若加入少量的氨水,使溶液中 c(NH4+)=c(Cl-),则溶液的 pH________7 (填“>”、“<”或“=”).
②氨水显碱性的原因(用离子方程式表示)________,向氨水中加入 NH4Cl 固体,氨水的电离程度________(填“增大”、“减小”或“不变”),溶液的 pH 将________(填“增大”、“减小”或“不变”)。
(2)下列事实中,能说明 NH3·H2O弱碱的有________
①0.1 mol·L-1 NH3·H2O 溶液可以使酚酞试液变红
②0.1 mol·L-1 NH4Cl 溶液呈酸性
③0.1 mol·L-1NH3·H2O 溶液的导电能力比 0.1 mol·L-1NaOH 溶液弱
④等体积的 0.1 mol·L-1NH3·H O 溶液与 0.1 mol·L-1 HCl 溶液恰好完全反应
A.①②③ B.②③ C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如图所示。活化氧可以快速氧化SO2。下列说法正确的是( )
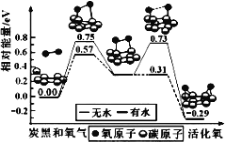
A.氧分子的活化是 O-O 的断裂与 C-O 键的生成过程
B.炭黑颗粒是大气中 SO2 转化为 SO3 的催化剂
C.每活化一个氧分子吸收 0.29eV 能量
D.水可使氧分子活化反应的活化能降低 0.42eV
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】凯氏定氨法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量。已知:
NH3+H3BO3=NH3·H3BO3;
NH3·H3BO3+HCl= NH4Cl+ H3BO3。
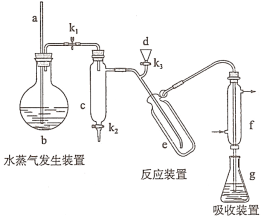
回答下列问题:
(1)a的作用是_______________。
(2)b中放入少量碎瓷片的目的是____________。f的名称是__________________。
(3)清洗仪器:g中加蒸馏水:打开k1,关闭k2、k3,加热b,蒸气充满管路:停止加热,关闭k1,g中蒸馏水倒吸进入c,原因是____________;打开k2放掉水,重复操作2~3次。
(4)仪器清洗后,g中加入硼酸(H3BO3)和指示剂,铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭k3,d中保留少量水,打开k1,加热b,使水蒸气进入e。
①d中保留少量水的目的是___________________。
②e中主要反应的离子方程式为________________,e采用中空双层玻璃瓶的作用是________。
(5)取某甘氨酸(C2H5NO2)样品m 克进行测定,滴定g中吸收液时消耗浓度为cmol·L-1的盐酸V mL,则样品中氮的质量分数为_________%,样品的纯度≤_______%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.c(H+)=![]() 的溶液一定呈中性
的溶液一定呈中性
B.将水加热,KW增大,pH不变,仍呈中性
C.向水中加入少量碳酸氢钠固体,溶液的c(H+) 增大,KW不变
D.向0.1mol·L-1醋酸溶液中加水,溶液中水电离产生的c(H+)将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向25ml氢氧化钠标准溶液中逐滴加入0.2mol·L1的一元酸HA溶液,PH变化曲线如下图所示:
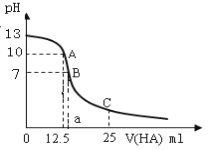
(1)该氢氧化钠溶液的物质的量浓度为__________mol·L1。
(2)A点对应酸的体积为12.5ml,则所得混合溶液中由水电离出的c(OH)= _______mol·L1。
(3)HA是____酸(选填“强”、“弱”)。
(4) 在B点所得混合溶液中,c(Na+)、c(A)、c(H+)、c(OH) 的大小的顺序是_____________。
(5)在C点所得混合溶液中,下列说正确的是________。
A.HA的电离程度小于NaA的水解程度
B.离子浓度由大到小的顺序是c(Na+)>c(A)>c(H+)>c(OH)
C.c(Na+) + c(H+) = c(A-) + c(OH)
D.c(HA) + c(A) = 0.2mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式不正确的是( )
A.CuO和稀盐酸反应:CuO+2H+=Cu2++H2O
B.BaCl2溶液和CuSO4溶液反应:Ba2++S![]() =BaSO4↓
=BaSO4↓
C.Fe与稀H2SO4反应:Fe+2H+=Fe2++H2↑
D.氢氧化钠溶液与盐酸反应:OH-+HCl=H2O+Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧锌锰电池含有锌、锰元素,主要含有ZnO、ZnMn2 O4、MnO、Mn2 O3、Mn3 O4、MnO2。利用废旧锌锰电池回收锌和制备二氧化锰、硫酸的工艺流程如图:
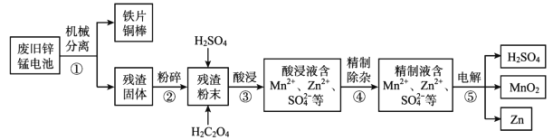
回答下列问题:
(1)步骤②“粉碎”的主要目的是______。
(2)步骤③“酸浸”发生了一系列反应:
ZnO+ H2SO4= ZnSO4 + H2O;MnO+ H2SO4= MnSO4 + H2O;
ZnMn2O4+2H2SO4=ZnSO4 + MnSO4 +2H2O+MnO2;
MnO2 + H2SO4 + H2C2O4=MnSO4 + 2CO2 ↑+2H2O。
推测 Mn2O3 与硫酸反应的离子方程式为______。
(3)如图分别表示“酸浸”时选用不同浓度硫酸和草酸对 Zn、Mn 浸出率的影响。
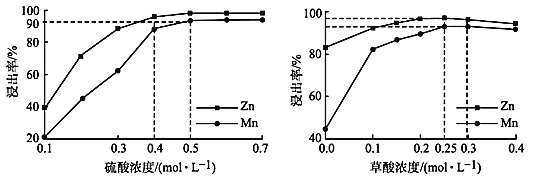
①为保证 Zn、Mn 的浸出率均大于 90%,步骤③需控制的 c(H2SO4) = ____mol/L。H2C2O4 浓度对 Mn 的浸出率影响程度大于 Zn,其原因是_____。
②假设“酸浸”所得溶液中Zn2+、Mn2+浓度相等。当 c(H2C2O4)>0.25 mol/L 时,Zn、Mn 的浸出率反而下降、且Zn 的浸出率下降先于Mn,其原因可能是_____(填序号)。
a.随着反应进行 c(H+)降低
b.Zn2+、Mn2+与 C2O42- 生成沉淀
c.溶解度:ZnC2O4<MnC2O4
(4)步骤⑤用惰性电极电解 ZnSO4 、MnSO4 的混合溶液,除生成 Zn、MnO2、H2SO4 外, 还可能生成 H2、O2 或其混合物。
①生成 MnO2 的电极反应式为_____ 。
②若 n (H2) :n (O2)=2:1,则参加反应的 n (Zn2+):n (Mn2+) = ______。
③该工艺流程中可循环利用的物质是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com