
【题目】炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如图所示。活化氧可以快速氧化SO2。下列说法正确的是( )
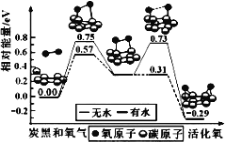
A.氧分子的活化是 O-O 的断裂与 C-O 键的生成过程
B.炭黑颗粒是大气中 SO2 转化为 SO3 的催化剂
C.每活化一个氧分子吸收 0.29eV 能量
D.水可使氧分子活化反应的活化能降低 0.42eV
科目:高中化学 来源: 题型:
【题目】检验甲醛含量的方法有很多,其中银﹣Ferrozine法灵敏度较高。测定原理为甲醛把氧化银还原成Ag,产生的Ag与Fe3+定量反应生成Fe2+,Fe2+与菲洛嗪(Ferrozine)形成有色配合物,通过测定吸光度计算出甲醛的含量。某学习小组类比此原理设计如下装置测定新装修居室内空气中甲醛的含量(夹持装置略去)。

已知:甲醛能被银氨溶液氧化生成CO2,氮化镁与水反应放出NH3,毛细管内径不超过1 mm。请回答下列问题:
(1)A装置中反应的化学方程式为___________,用饱和食盐水代替水制备NH3的原因是___________________。
(2)B中装有AgNO3溶液,仪器B的名称为________。
(3)银氨溶液的制备。关闭K1、K2,打开K3,打开______,使饱和食盐水慢慢滴入圆底烧瓶中,当观察到B中白色沉淀恰好完全溶解时,________。
(4)室内空气中甲醛含量的测定。
①用热水浴加热B,打开K1,将滑动隔板慢慢由最右端抽到最左端,吸入1 L室内空气,关闭K1;后续操作是______________;再重复上述操作3次。毛细管的作用是__________。
②向上述B中充分反应后的溶液中加入稀硫酸调节溶液pH=1,再加入足量Fe2(SO4)3溶液,充分反应后立即加入菲洛嗪,Fe2+与菲洛嗪形成有色物质,在562 nm处测定吸光度,测得生成Fe2+1.12 mg,空气中甲醛的含量为____mg·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是制备二氧化硫制取和吸收装置(加热装置已省略)分液漏斗中是液体反应试剂A,烧瓶中盛反应试剂B。完成下列填空:
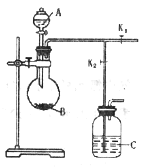
(1)实验室制备二氧化硫的试剂是_____________和________________。
(2)检验该气体发生装置气密性的方法是____________。
(3)装置C是吸收多余二氧化硫的装置,其中盛放的吸收剂为__________,实验结束进行尾气吸收时,对活塞开关K1、K2的控制是_____________________。
(4)如果用该套装置制备盐酸,此时C瓶所加试剂为_____________,此时C中液体可能会发生倒吸,如果不改变现有的装置,要克服这一安全隐患,可以在C瓶中再加入有机试剂封住长导管管口,该有机试剂可以为___________,吸收后,将 C瓶中的液体经过_____操作获得盐酸。
(5)甲同学用该装置测定一定质量小苏打样品(含少量NaCl)中碳酸氢钠的纯度,可以在C中加入氢氧化钠溶液吸收二氧化碳,通过C瓶增重得到二氧化碳质量,计算出碳酸氢钠的含量,实验结果小苏打含量偏低,你认为实验结果偏低的原因是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得。下列叙述正确的是( )
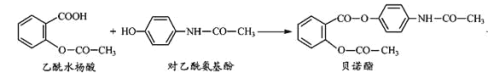 +H2O
+H2O
A.贝诺酯分子中有三种含氧官能团
B.贝诺酯与足量 NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠
C.乙酰水杨酸和对乙酰氨基酚均能与 NaHCO3溶液反应
D.可用 FeCl3 溶液区别乙酰水杨酸和对乙酰氨基酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气里含有 NO 气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)2NO(g) ΔH>0,已知该反应在 240℃时,平衡常数 K=64×10-4。请回答:
(1)该温度下,向 2 L 的密闭容器中充入 N2 和 O2 各 1 mol,5分钟后O2的物质的量为 0.5 mol,则 用N2表示的反应速率为________。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志________ (填字母序号)。
A.消耗 1 mol N2 同时生成 1 mol O2 B.混合气体密度不变
C.混合气体平均相对分子质量不变 D.2v(N2)正=v(NO)逆
(3)将 N2、O2 的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是________ (填字母序号)。
A. 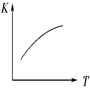 B.
B. 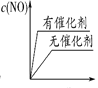 C.
C. 
(4)该温度下,某时刻测得容器内 N2 、O2、NO 的浓度分别为 2.5×10-1 mol·L-1、4.0×10-2 mol·L-1和 3.0×10-3mol·L-1,此时反应________ (填“处于化学平衡状态”“向正反应方向进行”或“向逆反应方向进行”),理由是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如图:
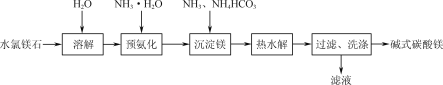
(1)为提高溶解速率,可以采取的措施有__(写一条)。
(2)检验碱式碳酸镁是否洗净的操作为___。
(3)预氨化过程中有Mg(OH)2沉淀生成,该过程发生反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知咖啡酸的结构如图所示:
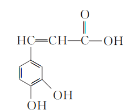
(1)咖啡酸属于__(填“无机化合物”或“有机化合物”)。
(2)咖啡酸中含氧官能团有羟基和__(填名称)。
(3)向咖啡酸溶液中滴加NaHCO3溶液,实验现象为__。
(4)咖啡酸溶液能使酸性高锰酸钾溶液褪色,说明咖啡酸具有__性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超临界状态下的CO2流体溶解性与有机溶剂相似,可提取中药材的有效成分,工艺流程如下。
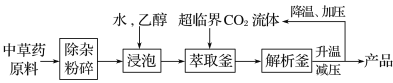
下列说法中错误的是( )
A.浸泡时加入乙醇有利于中草药有效成分的浸出
B.高温条件下更有利于超临界CO2流体萃取
C.升温、减压的目的是实现CO2与产品分离
D.超临界CO2流体萃取中药材具有无溶剂残留、绿色环保等优点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)=2C(g)+D(g),经2 min,B的浓度减少0.6 mol·L-1。对此反应速率的表示,正确的是( )
A.用A表示的反应速率是0.4 mol·(L·min)-1
B.分别用B、C、D表示反应的速率,其比是3∶2∶1
C.在2 min末的反应速率,用B表示是0.3 mol·(L·min)-1
D.在这2 min内用B和C表示的平均反应速率的值相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com