
【题目】如图是制备二氧化硫制取和吸收装置(加热装置已省略)分液漏斗中是液体反应试剂A,烧瓶中盛反应试剂B。完成下列填空:
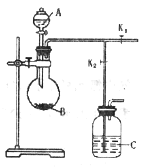
(1)实验室制备二氧化硫的试剂是_____________和________________。
(2)检验该气体发生装置气密性的方法是____________。
(3)装置C是吸收多余二氧化硫的装置,其中盛放的吸收剂为__________,实验结束进行尾气吸收时,对活塞开关K1、K2的控制是_____________________。
(4)如果用该套装置制备盐酸,此时C瓶所加试剂为_____________,此时C中液体可能会发生倒吸,如果不改变现有的装置,要克服这一安全隐患,可以在C瓶中再加入有机试剂封住长导管管口,该有机试剂可以为___________,吸收后,将 C瓶中的液体经过_____操作获得盐酸。
(5)甲同学用该装置测定一定质量小苏打样品(含少量NaCl)中碳酸氢钠的纯度,可以在C中加入氢氧化钠溶液吸收二氧化碳,通过C瓶增重得到二氧化碳质量,计算出碳酸氢钠的含量,实验结果小苏打含量偏低,你认为实验结果偏低的原因是_________________________。
【答案】亚硫酸钠固体 浓硫酸 关闭K1、K2,从A中加水,水无法持续流入B,则气密性良好 氢氧化钠溶液 关闭活塞K1、打开活塞K2 水 四氯化碳 分液 气体滞留在B瓶中
【解析】
(1)实验室制取二氧化硫常用亚硫酸钠固体和浓硫酸;
(2)检查装置气密性可以用微热法或液差法;
(3)二氧化硫有毒,需用碱液吸收,防止扩散到空气中去;
(4)氯化氢气体溶于水可得盐酸,HCl气体极易溶于水,应防倒吸,CCl4的密度比水大且不溶于水;
(5)生成的二氧化碳没有全部被NaOH溶液吸收。
(1)实验室制取二氧化硫常用亚硫酸钠固体和浓硫酸,因为二氧化硫易溶于水,所以硫酸浓度不能太低,也可以用Cu与浓硫酸加热制取,故答案为:亚硫酸钠固体;浓硫酸;
(2)检查该装置气密性可以关闭K1、K2,从A中加水,水无法持续流入B,则气密性良好,或关闭K1,打开K2,微热B,若C中导管产生气泡,停止加热后,C中导管液柱上升,高于瓶内液面,则气密性良好,故答案为:关闭K1、K2,从A中加水,水无法持续流入B,则气密性良好;
(3)二氧化硫有毒,能够与碱溶液反应,需用氢氧化钠溶液吸收,防止扩散到空气中去;实验结束进行尾气吸收时,对活塞开关K1、K2的控制是关闭活塞K1、打开活塞K2,故答案为:氢氧化钠溶液;关闭活塞K1、打开活塞K2;
(4)HCI气体极易溶于水,可以在C瓶中再加入有机试剂CCl4封住长导管管口防倒吸,最后通过分液得到盐酸,故答案为:水,四氯化碳;分液;
(5)B瓶以及导管中有二氧化碳不能被NaOH溶液吸收,导致结果小苏打含量偏低,故答案为:气体滞留在B瓶中。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关,下列说法不正确的是
A.中国天眼FAST用到的碳化硅是一种新型无机非金属材料
B.氯水放置数天后,漂白性和酸性均减弱
C.由石油的裂解可以得到乙烯、丙烯等主要化工基本原料
D.某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因水中生成了硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其电极a常用掺有石墨烯的S8材料,电极反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法正确的是
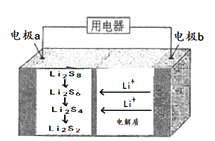
A. 电池工作时,外电路中流过0.02mol电子,负极材料减重0.14g
B. 电解池中加入少量硫酸增强导电性
C. 电池充电时间越长,电池中的Li2S2量越多
D. 电池工作时,负极可发生反应: 2Li2S6+2Li++2e-=3Li2S4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如图,其中电解池中隔膜仅阻止气体通过,阴、阳极均为石墨电极。下列相关叙述正确的是
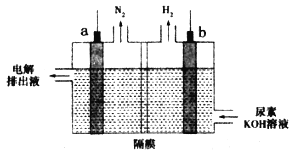
A.b电极为阳极
B.电子由b电极经过溶液流入a电极形成回路
C.b电极上发生失去电子的反应
D.尿素在a电极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】洋蓟属高档蔬菜,从洋蓟提取的物质A具有良好的保健功能和药用价值,A的结构如图。下列关于A的相关叙述正确的是
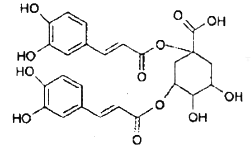
A.A在酸性条件下可以发生水解反应
B.1mol A和足量NaOH溶液反应,最多消耗9mol NaOH
C.A能和浓溴水发生加成和取代反应
D.A含4种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热△H=-57.3 kJ·mol1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol1
B. 甲烷的标准燃烧热ΔH=-890.3 kJ·mol1,则CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH<-890.3 kJ·mol1
C. 已知:500℃、30MPa下,N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
D. CO(g)的燃烧热是283.0kJ·mol1,则2CO2(g) ===2CO(g)+O2(g)反应的△H=+566.0 kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃时,浓度均为 0.10molL﹣1 的氨水和 NH4 Cl 溶液
①NH4 Cl 溶液显________性,原因是(用离子方程式表示)________,若加入少量的氨水,使溶液中 c(NH4+)=c(Cl-),则溶液的 pH________7 (填“>”、“<”或“=”).
②氨水显碱性的原因(用离子方程式表示)________,向氨水中加入 NH4Cl 固体,氨水的电离程度________(填“增大”、“减小”或“不变”),溶液的 pH 将________(填“增大”、“减小”或“不变”)。
(2)下列事实中,能说明 NH3·H2O弱碱的有________
①0.1 mol·L-1 NH3·H2O 溶液可以使酚酞试液变红
②0.1 mol·L-1 NH4Cl 溶液呈酸性
③0.1 mol·L-1NH3·H2O 溶液的导电能力比 0.1 mol·L-1NaOH 溶液弱
④等体积的 0.1 mol·L-1NH3·H O 溶液与 0.1 mol·L-1 HCl 溶液恰好完全反应
A.①②③ B.②③ C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如图所示。活化氧可以快速氧化SO2。下列说法正确的是( )
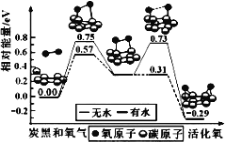
A.氧分子的活化是 O-O 的断裂与 C-O 键的生成过程
B.炭黑颗粒是大气中 SO2 转化为 SO3 的催化剂
C.每活化一个氧分子吸收 0.29eV 能量
D.水可使氧分子活化反应的活化能降低 0.42eV
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式不正确的是( )
A.CuO和稀盐酸反应:CuO+2H+=Cu2++H2O
B.BaCl2溶液和CuSO4溶液反应:Ba2++S![]() =BaSO4↓
=BaSO4↓
C.Fe与稀H2SO4反应:Fe+2H+=Fe2++H2↑
D.氢氧化钠溶液与盐酸反应:OH-+HCl=H2O+Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com