
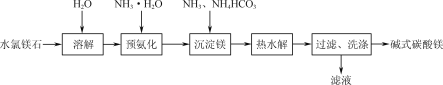
【题目】以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如图:
(1)为提高溶解速率,可以采取的措施有__(写一条)。
(2)检验碱式碳酸镁是否洗净的操作为___。
(3)预氨化过程中有Mg(OH)2沉淀生成,该过程发生反应的离子方程式为___。
【答案】将水氯镁石粉碎 取最后一次洗涤液少许于试管中,滴加稀HNO3酸化的AgNO3溶液,若产生白色沉淀,说明碱式碳酸镁未洗净,反之已洗净 Mg2++2NH3·H2O=Mg(OH)2↓+2NH4+
【解析】
水氯镁石(主要成分为MgCl2·6H2O)粉碎溶于水或溶解时不断搅拌,加入氨水进行预氨化处理,再加入氨气和碳酸氢铵反应,再经过热水解得到碱式碳酸镁,经过过滤、洗涤获得产品。
⑴为提高溶解速率,可以采取的措施有将水氯镁石粉碎或不断搅拌;故答案为:将水氯镁石粉碎。
⑵检验碱式碳酸镁是否洗净,主要是检验最后一次洗液里是否含有氯离子,因此其操作为取最后一次洗涤液少许于试管中,滴加稀HNO3酸化的AgNO3溶液,若产生白色沉淀,说明碱式碳酸镁未洗净,反之已洗净;故答案为:取最后一次洗涤液少许于试管中,滴加稀HNO3酸化的AgNO3溶液,若产生白色沉淀,说明碱式碳酸镁未洗净,反之已洗净。
⑶预氨化过程中有Mg(OH)2沉淀生成,是氯化镁和氨水反应生成Mg(OH)2沉淀,该过程发生反应的离子方程式为Mg2++2NH3·H2O=Mg(OH)2↓+2NH4+;故答案为:Mg2++2NH3·H2O =Mg(OH)2↓+2NH4+。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H4与N2O4能放出大量的热。
(1)已知:2NO2(g)=N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g)=N2O4(g) 达到平衡。其它条件不变时,下列措施:
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
能提高NO2转化率的是_______(填字母)。
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O (l) ,放出19.14kJ
的热量。则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O (l)的△H=______kJ·mol-1。
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300mol·L-1、c(N2O4)=0.0120mol·L-1。计算反应2 NO2(g)![]() N2O4(g)的平衡常数K=______。
N2O4(g)的平衡常数K=______。
(4)现用一定量的Cu 与足量的浓HNO3反应,制得1.00L已达平衡的N2O4和NO2
混合气体(17℃、1.01×105Pa),理论上至少需消耗Cu的质量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热△H=-57.3 kJ·mol1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol1
B. 甲烷的标准燃烧热ΔH=-890.3 kJ·mol1,则CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH<-890.3 kJ·mol1
C. 已知:500℃、30MPa下,N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
D. CO(g)的燃烧热是283.0kJ·mol1,则2CO2(g) ===2CO(g)+O2(g)反应的△H=+566.0 kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学工作者研发了一种 SUNCAT的系统,借助锂循环可持续,合成其原理如图所示。下列说法不正确的是
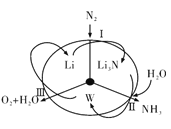
A. 过程I得到的Li3N的电子式为![]()
B. 过程Ⅱ生成W的反应为Li3N+3H2O=3LiOH+NH3↑
C. 过程Ⅲ涉及的阳极反应为4OH--4e-=O2↑+2H2O
D. 过程I、Ⅱ、Ⅲ均为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如图所示。活化氧可以快速氧化SO2。下列说法正确的是( )
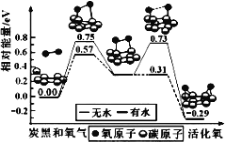
A.氧分子的活化是 O-O 的断裂与 C-O 键的生成过程
B.炭黑颗粒是大气中 SO2 转化为 SO3 的催化剂
C.每活化一个氧分子吸收 0.29eV 能量
D.水可使氧分子活化反应的活化能降低 0.42eV
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2-氨基-3-氯苯甲酸(F)是重要的医药中间体,其制备流程图如下:
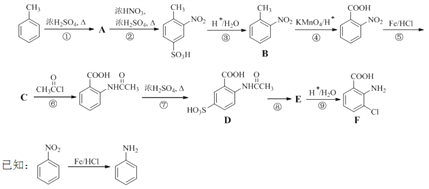
回答下列问题:
(1)![]() 分子中不同化学环境的氢原子共有_______种,共面原子数目最多为_______。
分子中不同化学环境的氢原子共有_______种,共面原子数目最多为_______。
(2)B的名称为_________。写出符合下列条件B的所有同分异构体的结构简式_______。
a.苯环上只有两个取代基且互为邻位 b.既能发生银镜反应又能发生水解反应
(3)该流程未采用甲苯直接硝化的方法制备B,而是经由①②③三步反应制取B,其目的是______________。
(4)写出⑥的化学反应方程式:_________,该步反应的主要目的是____________。
(5)写出⑧的反应试剂和条件:_______________;F中含氧官能团的名称为__________。
(6)在方框中写出以 为主要原料,经最少步骤制备含肽键聚合物的流程。__________
为主要原料,经最少步骤制备含肽键聚合物的流程。__________
 ……
……![]() 目标化合物
目标化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.c(H+)=![]() 的溶液一定呈中性
的溶液一定呈中性
B.将水加热,KW增大,pH不变,仍呈中性
C.向水中加入少量碳酸氢钠固体,溶液的c(H+) 增大,KW不变
D.向0.1mol·L-1醋酸溶液中加水,溶液中水电离产生的c(H+)将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是重要的清洁能源。科学家尝试多种方法制取氢气。
I.(1)储氢材料![]() 能与水反应得到氢气。请写出
能与水反应得到氢气。请写出![]() 的电子式______________,该反应的化学方程式为______________________________。
的电子式______________,该反应的化学方程式为______________________________。
Ⅱ.甘油和水蒸气、氧气经催化重整或部分催化氧化可制得氢气,反应主要过程如下:
甘油水蒸气重整( |
|
甘油部分氧化( |
|
甘油氧化水蒸汽重整( |
|
(2)反应![]() 的H1=_____ kJmol-1。
的H1=_____ kJmol-1。
(3)实际生产中将反应![]() 设定在600~700℃进行,选择该温度范围的原因是:________________。
设定在600~700℃进行,选择该温度范围的原因是:________________。
(4)反应![]() 的副产物很多,加入一定量的
的副产物很多,加入一定量的![]() 通入适当过量的
通入适当过量的![]() 都能提高氢气的产率。则加入
都能提高氢气的产率。则加入![]() 的原因:___________________;若混合气体中,
的原因:___________________;若混合气体中,![]() 比例过高,则
比例过高,则![]() 产率降低,其原因是:____________________________。
产率降低,其原因是:____________________________。
(5)通常将![]() 分散在高比表面的载体(
分散在高比表面的载体(![]() )上以提高催化效率。分别用三种催化剂的载体进行实验,持续通入原料气一段时间,绘制油转化率与时间的关系如图所示。
)上以提高催化效率。分别用三种催化剂的载体进行实验,持续通入原料气一段时间,绘制油转化率与时间的关系如图所示。

①结合上图分析![]() 催化剂具有的优点是____________________。
催化剂具有的优点是____________________。
②研究发现造成催化效率随时间下降的主要原因是副反应产生的大量碳粉(积碳)包裹催化剂,通过加入微量的、可循环利用的氧化镧(![]() )可有效减少积碳。其反应机理包括两步:
)可有效减少积碳。其反应机理包括两步:
第一步为:![]()
第二步为:___________________________(写出化学反应方程式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。室温下,下列关于 1 L 0.1 mol/L FeCl3 溶液的说法中正确的是
A.溶液中含有的 Fe3+离子数目为 0.1NA
B.加入 Cu 粉,转移电子数目为 0.1NA
C.加水稀释后,溶液中 c(OH-) 减小
D.加入 0. 15 mol NaOH 后,3c(Fe3+)+c(H+) = c(Na+) + c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com