
【题目】科学工作者研发了一种 SUNCAT的系统,借助锂循环可持续,合成其原理如图所示。下列说法不正确的是
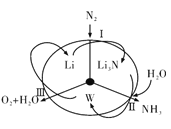
A. 过程I得到的Li3N的电子式为![]()
B. 过程Ⅱ生成W的反应为Li3N+3H2O=3LiOH+NH3↑
C. 过程Ⅲ涉及的阳极反应为4OH--4e-=O2↑+2H2O
D. 过程I、Ⅱ、Ⅲ均为氧化还原反应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】硫在自然界的循环过程如图所示。下列说法中,不正确的是
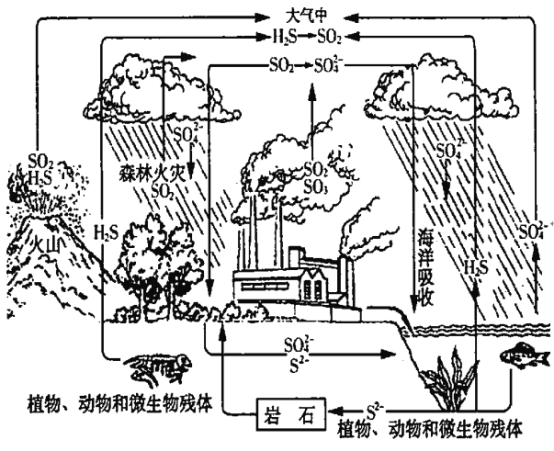
A. 火山喷发、森林火灾会产生SO2
B. 氢、氧两种元素没有参与硫的循环
C. 工厂产生的烟气应经脱硫处理后再排放
D. 硫在自然界的循环过程中,涉及了氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
(1)实验室用金属铜和稀硝酸制取NO的离子方程式为:__________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
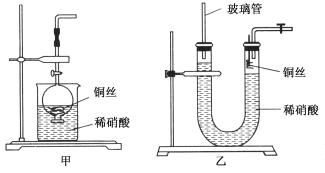
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填选项编号)。
A.铁B.铝C.铂D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是____________________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。长玻璃管的作用是______________________________________________。
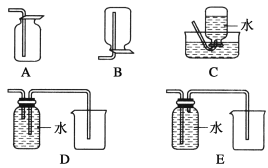
(4)以下收集NO气体的装置,合理的是________(填选项代号)。
(5)假设实验中12.8gCu全部溶解,需要通入标况下________LO2才能使NO全部溶于水。
(6)用金属铜制取硝酸铜,从节约原料和防止环境污染的角度考虑,下列4种方法中最好的是________(填“甲”、“乙”、“丙”或“丁”),理由是____________________________。
甲:铜+浓硝酸→硝酸铜
乙:铜+稀硝酸→硝酸铜
丙:铜+氯气→氯化铜;氯化铜+硝酸→硝酸铜
丁:铜+空气→氧化铜;氧化铜+硝酸→硝酸铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=-24.8 kJ·mol-1
Fe2O3(s)+![]() CO(g)===
CO(g)===![]() Fe3O4(s)+
Fe3O4(s)+![]() CO2(g) ΔH=-15.73 kJ·mol-1
CO2(g) ΔH=-15.73 kJ·mol-1
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH=640.4 kJ·mol-1
则14gCO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为( )
A. -218 kJ·mol-1B. -109 kJ·mol-1
C. 218 kJ·mol-1D. 109 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纯净的CaCO3与100 mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积)。下列分析正确的是( )
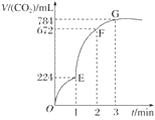
A. OE段表示的平均速率最快
B. EF段,用盐酸表示该反应的平均反应速率为0.04 mol·L-1·min-1
C. OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2∶6∶7
D. G点表示收集的CO2的量最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量Na2CO3、NaHCO3组成的混合物溶于水配成50 mL溶液,逐滴加入稀盐酸,得到各成分物质的量变化如图所示(忽略溶液混合导致的体积变化,已知1 mol=1000 mmol)。
下列说法不正确的是
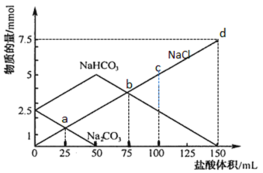
A.盐酸的物质的量浓度为0.05 mol·L-1
B.c点溶液中c(NaCl)=0.05 mol·L-1
C.a点溶液中发生反应的离子方程式为:CO![]() + H+ = HCO
+ H+ = HCO![]()
D.b点和d点所处的溶液中n(Na+)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性:H2SO3>H2CO3>HSO![]() >HCO
>HCO![]() ,某无色溶液Y中可能含有以下几种离子:Cl-、SO
,某无色溶液Y中可能含有以下几种离子:Cl-、SO![]() 、HCO
、HCO![]() 、HSO
、HSO![]() 、Fe3+、Ba2+、NH
、Fe3+、Ba2+、NH![]() 、Na+,溶液中阳离子浓度相同,为了确定其组成,某课题小组进行如下实验(假设气体均全部逸出、忽略H2O2的分解)
、Na+,溶液中阳离子浓度相同,为了确定其组成,某课题小组进行如下实验(假设气体均全部逸出、忽略H2O2的分解)
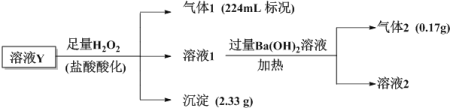
下列说法不正确的是
A.溶液1中一定不存在Fe3+、SO![]()
B.气体1为CO2气体
C.溶液Y中一定含有Cl-,且n(Cl-)=0.01mol
D.溶液Y中可能存在Na+,可取溶液1通过焰色反应实验验证
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸亚铁锂(LiFePO4)是目前使用量最多的一种锂电池电极材料,LiFePO4废料中(含Al、石墨)磷、铁、锂的综合回收工艺流程图:
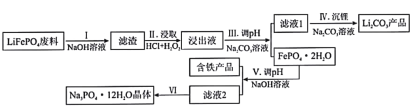
已知:①![]() ,
,![]()
②常温下,![]() ,
,![]() ,
,![]()
(1)过程I“碱浸”的目的是____________,该过程发生反应的离子方程式为_________________。
(2)过程II“酸浸”加人双氧水的目的是_________________。
(3)①浸出液中存在大量![]() 、
、![]() 离子,从平衡移动角度解释过程Ⅲ得到磷酸铁晶体的原因_________________。
离子,从平衡移动角度解释过程Ⅲ得到磷酸铁晶体的原因_________________。
②一定条件下,探究了pH对磷酸铁沉淀的影响,结果如图所示。由图可知,过程Ⅲ应选取的最佳沉淀pH为____。随pH的增加,磷的沉淀率开始下降,而铁沉淀率未下降,分析原因为_________________。
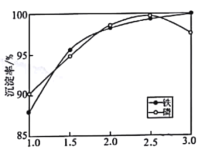
(4)测得滤液1中c(Li+)=0.l5mol/L,某同学取该100mL滤液进行“沉锂”反应.加入50mlNa2CO3溶液却未见沉淀,若不考虑Na2CO3的水解和液体混合时的体积变化,则该同学加入的Na2CO3溶液最大浓度为c(Na2CO3)=_____________mol/L
(5)过程Ⅵ将滤液2________,________,经过滤、干燥后得Na3PO4·12H2O晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如图示的装置进行试验。通入二氧化硫气体,将带余烬的木条插入试管中,木条复燃。
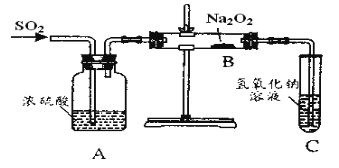
请回答下列问题:
(1)第一小组同学认为Na2O2与SO2反应生成的白色固体中含有Na2SO3和O2该反应的化学方程式为___。
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3___。
(3)第二小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:
将B中反应后的固体溶解于水(再加BaCl2溶液)→白色沉淀→(加入稀硝酸)仍有部分白色沉淀不溶解,证明有Na2SO4生成。上述方案是否合理?___;请简要说明理由:__。
(4)在100mL混合溶液中,HNO3和H2SO4的物质的量浓度分别是0.4mol/L,0.1mol/L向该混合液中加入1.92g铜粉,加热待充分反应后,所得溶液中Cu2+的物质的量浓度是__(填选项字母)。
A.0.15 B.0.225 C.0.35 D.0.45
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com