
【题目】已知下列热化学方程式:
Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=-24.8 kJ·mol-1
Fe2O3(s)+![]() CO(g)===
CO(g)===![]() Fe3O4(s)+
Fe3O4(s)+![]() CO2(g) ΔH=-15.73 kJ·mol-1
CO2(g) ΔH=-15.73 kJ·mol-1
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH=640.4 kJ·mol-1
则14gCO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为( )
A. -218 kJ·mol-1B. -109 kJ·mol-1
C. 218 kJ·mol-1D. 109 kJ·mol-1
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述中正确的是( )
4NO(g)+6H2O(g),下列叙述中正确的是( )
A.达到化学平衡时4υ正(O2)=5υ逆(NO)
B.若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达平衡状态
C.达到化学平衡时,若升高温度,则正反应速率减小,逆反应速率增大
D.平衡时混合物中可能各物质的浓度相等,且保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物P是合成抗肿瘤药物的中间体,其合成路线如下:
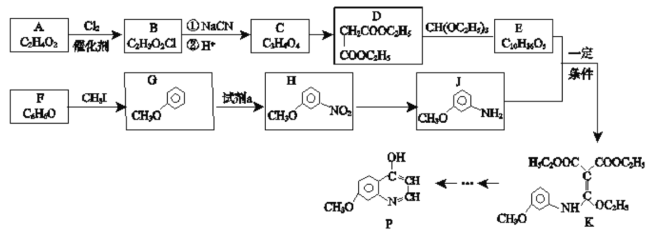
已知:RCl![]() RCOOH
RCOOH
(1)H的官能团名称___________。写出E的结构简式___________。
(2)B→C中①的化学方程式___________。
(3)检验F中官能团的试剂及现象_________。
(4)D的同分异构体有多种,其中满足以下条件的有________种。
①1mol D能与足量 NaHCO3反应放出2mol CO2
②核磁共振氢谱显示有四组峰
(5)H→J的反应类型___________。
(6)已知: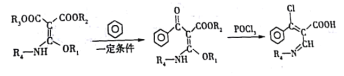
K经过多步反应最终得到产物P:
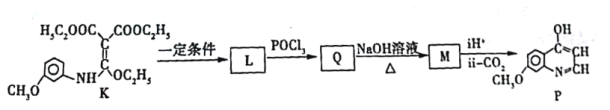
①K→L的化学方程式___________。
②写出M的结构简式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为_______nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)基态K原子中,核外电子占据的最高能层的符号是_________,占据该能层电子的电子云轮廓图形状为___________。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是___________________________。
(3)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为_____________,中心原子的杂化形式为________________。
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为______nm,与K紧邻的O个数为__________。
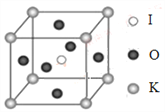
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe 三种金属元素组成,回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_______方法区分晶体、准晶体和非晶体。
(2)基态 Fe原子有_______个未成对电子,Fe3+的电子排布式为 _____,可用硫氰化钾检验Fe3+,形成的配合物的颜色为________ 。
(3)新制备的Cu(OH)2可将乙醛〔CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道类型为____________,乙酸的沸点明显高于乙醛,其主要原因是________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有_______个铜原子。
(4)Al单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为_____ 。列式表示Al单质的密度___________g·cm-3(不必计算出结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是()
A.Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
B.用铜作电极电解食盐水:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
C.向氧化铁中加入氢碘酸:Fe2O3+6H+=2Fe3++3H2O
D.向一定量明矾溶液中滴加Ba(OH)2溶液至生成沉淀的物质的量最多:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学工作者研发了一种 SUNCAT的系统,借助锂循环可持续,合成其原理如图所示。下列说法不正确的是
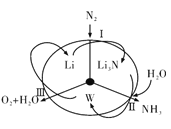
A. 过程I得到的Li3N的电子式为![]()
B. 过程Ⅱ生成W的反应为Li3N+3H2O=3LiOH+NH3↑
C. 过程Ⅲ涉及的阳极反应为4OH--4e-=O2↑+2H2O
D. 过程I、Ⅱ、Ⅲ均为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A,B,C,D,E,F均为周期表中前36号元素,且原子序数依次增大.A,B,C为同一周期的主族元素,B原子p能级电子总数与s能级电子总数相等.A,F原子未成对电子是同周期中最多的,且F基态原子中电子占据三种不同形状的原子轨道.D和E原子的第一至第四电离能如下表所示:
电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
D | 738 | 1451 | 7733 | 10540 |
E | 578 | 1817 | 2745 | 11578 |
(1)A,B,C三种元素的电负性最大的是__(填写元素符号),D,E两元素中D的第一电离能较大的原因是__.
(2)F基态原子的核外电子排布式是__;在一定条件下,F原子的核外电子从基态跃迁到激发态产生的光谱属于__光谱(填“吸收”或“发射”).
(3)根据等电子原理,写出AB+的电子式:__.
(4)已知:F3+可形成配位数为6的配合物.组成为FCl36H2O的配合物有3种,分别呈紫色、蓝绿色、绿色,为确定这3种配合物的成键情况,分别取等质量的紫色、蓝绿色、绿色3种物质的样品配成溶液,分别向其中滴入过量的AgNO3溶液,均产生白色沉淀且质量比为3:2:1.则绿色配合物的化学式为__.
A [CrCl(H2O)5]Cl2H2O B [CrCl2(H2O)4]Cl2H2O
C [Cr(H2O)6]Cl3 D [CrCl3(H2O)3]3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com