
【题目】已知A,B,C,D,E,F均为周期表中前36号元素,且原子序数依次增大.A,B,C为同一周期的主族元素,B原子p能级电子总数与s能级电子总数相等.A,F原子未成对电子是同周期中最多的,且F基态原子中电子占据三种不同形状的原子轨道.D和E原子的第一至第四电离能如下表所示:
电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
D | 738 | 1451 | 7733 | 10540 |
E | 578 | 1817 | 2745 | 11578 |
(1)A,B,C三种元素的电负性最大的是__(填写元素符号),D,E两元素中D的第一电离能较大的原因是__.
(2)F基态原子的核外电子排布式是__;在一定条件下,F原子的核外电子从基态跃迁到激发态产生的光谱属于__光谱(填“吸收”或“发射”).
(3)根据等电子原理,写出AB+的电子式:__.
(4)已知:F3+可形成配位数为6的配合物.组成为FCl36H2O的配合物有3种,分别呈紫色、蓝绿色、绿色,为确定这3种配合物的成键情况,分别取等质量的紫色、蓝绿色、绿色3种物质的样品配成溶液,分别向其中滴入过量的AgNO3溶液,均产生白色沉淀且质量比为3:2:1.则绿色配合物的化学式为__.
A [CrCl(H2O)5]Cl2H2O B [CrCl2(H2O)4]Cl2H2O
C [Cr(H2O)6]Cl3 D [CrCl3(H2O)3]3H2O
【答案】F 原子外围电子排布为3s2,s轨道全充满,相对稳定 1s22s22p63s23p63d54s1 吸收 ![]() [CrCl2(H2O)4]Cl2H2O
[CrCl2(H2O)4]Cl2H2O
【解析】
A、B、C、D、E、F均为周期表中前36号元素,且原子序数依次增大。B原子p能级电子总数与s能级电子总数相等,核外电子排布为1s22s22p4或1s22s22p63s2,则B为O元素或Mg元素;A、B、C为同一周期的主族元素,A原子未成对电子是同周期中最多的,外围电子排布为ns2np3,因为A的原子序数小于B元素,故B为氧元素、A为N元素,C为氟元素;F基态原子中电子占据三种不同形状的原子轨道,有s、p、d轨道,处于第四周期,原子未成对电子是同周期中最多的,外围电子排布为3d54s1,则F为Cr元素;D原子的第三电离能剧增,表现+2价,处于ⅡA族,E原子的第四电离能剧增,表现+3价,处于ⅢA族,二者原子序数小于Cr元素,故E为Al元素,D为Mg元素,据此解答。
综合以上分析,A为N元素,B为O元素,C为F元素,D为Mg元素,E为Al元素,F为Cr元素,
(1)同周期自左而右电负性增大,故F元素的电负性最大;Mg原子外围电子排布为3s2,s轨道全充满,相对稳定,第一电离能大于Al元素,
因此,本题正确答案是:F;原子外围电子排布为3s2,s轨道全充满,相对稳定;
(2)Cr原子核外电子数为24,基态原子的核外电子排布式是1s22s22p63s23p63d54s1;在一定条件下,F原子的核外电子从基态跃迁到激发态,需要吸收能量,产生的光谱属于吸收光谱,因此,本题正确答案是:1s22s22p63s23p63d54s1;吸收;
(3)NO+与N2为等电子体,电子式类似,故NO+电子式为:![]() ,
,
因此,本题正确答案是:![]() ;
;
(4)已知:Cr3+可形成配位数为6的配合物。组成为CrCl36H2O的配合物有3种,分别呈紫色、蓝绿色、绿色,为确定这3种配合物的成键情况,分别取等质量的紫色、蓝绿色、绿色3种物质的样品配成溶液,分别向其中滴入过量的AgNO3溶液,均产生白色沉淀且质量比为3:2:1,则绿色配合物的化学式中配体有2个氯离子、4个水分子,则绿色配合物的化学式为[CrCl2(H2O)4]Cl2H2O,
因此,本题正确答案是:[CrCl2(H2O)4]Cl2H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】检验溶液中的离子,实验步骤和结论均正确的是
A.加入AgNO3溶液,有白色沉淀生成,一定含有Cl-离子
B.加入HNO3酸化的Ba(NO3)2溶液有白色沉淀生成,一定含有![]() 离子
离子
C.加入淀粉溶液变蓝,可能含有I2
D.加入BaCl2溶液,有白色沉淀,一定含有![]() 离子
离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=-24.8 kJ·mol-1
Fe2O3(s)+![]() CO(g)===
CO(g)===![]() Fe3O4(s)+
Fe3O4(s)+![]() CO2(g) ΔH=-15.73 kJ·mol-1
CO2(g) ΔH=-15.73 kJ·mol-1
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH=640.4 kJ·mol-1
则14gCO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为( )
A. -218 kJ·mol-1B. -109 kJ·mol-1
C. 218 kJ·mol-1D. 109 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量Na2CO3、NaHCO3组成的混合物溶于水配成50 mL溶液,逐滴加入稀盐酸,得到各成分物质的量变化如图所示(忽略溶液混合导致的体积变化,已知1 mol=1000 mmol)。
下列说法不正确的是
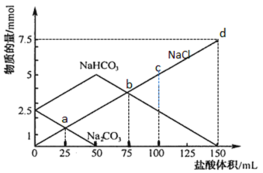
A.盐酸的物质的量浓度为0.05 mol·L-1
B.c点溶液中c(NaCl)=0.05 mol·L-1
C.a点溶液中发生反应的离子方程式为:CO![]() + H+ = HCO
+ H+ = HCO![]()
D.b点和d点所处的溶液中n(Na+)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性:H2SO3>H2CO3>HSO![]() >HCO
>HCO![]() ,某无色溶液Y中可能含有以下几种离子:Cl-、SO
,某无色溶液Y中可能含有以下几种离子:Cl-、SO![]() 、HCO
、HCO![]() 、HSO
、HSO![]() 、Fe3+、Ba2+、NH
、Fe3+、Ba2+、NH![]() 、Na+,溶液中阳离子浓度相同,为了确定其组成,某课题小组进行如下实验(假设气体均全部逸出、忽略H2O2的分解)
、Na+,溶液中阳离子浓度相同,为了确定其组成,某课题小组进行如下实验(假设气体均全部逸出、忽略H2O2的分解)
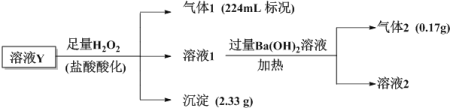
下列说法不正确的是
A.溶液1中一定不存在Fe3+、SO![]()
B.气体1为CO2气体
C.溶液Y中一定含有Cl-,且n(Cl-)=0.01mol
D.溶液Y中可能存在Na+,可取溶液1通过焰色反应实验验证
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C物质为烃类,在标准状况下的密度为1.16g/L,F物质具有水果香味,G物质不能水解。转化关系如图所示,省略了反应条件。
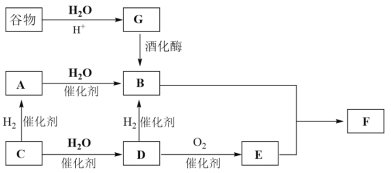
请回答下列问题:
(1)写出G的分子式:____________________。
(2)D中官能团的名称是__________________________。 C→A的反应类型____________
(3)请写出反应B+E→F的化学方程式:______________________。
(4)下列有关说法正确的是_____________________________。
A.C物质燃烧时,易产生大量黑烟 B.物质B和甘油(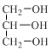 )互为同系物
)互为同系物
C.一定条件下,A可被直接氧化为D D.用NaOH溶液可以区分B、D、F
查看答案和解析>>
科目:高中化学 来源: 题型:
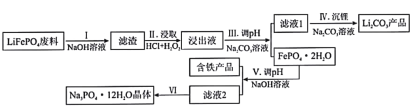
【题目】磷酸亚铁锂(LiFePO4)是目前使用量最多的一种锂电池电极材料,LiFePO4废料中(含Al、石墨)磷、铁、锂的综合回收工艺流程图:
已知:①![]() ,
,![]()
②常温下,![]() ,
,![]() ,
,![]()
(1)过程I“碱浸”的目的是____________,该过程发生反应的离子方程式为_________________。
(2)过程II“酸浸”加人双氧水的目的是_________________。
(3)①浸出液中存在大量![]() 、
、![]() 离子,从平衡移动角度解释过程Ⅲ得到磷酸铁晶体的原因_________________。
离子,从平衡移动角度解释过程Ⅲ得到磷酸铁晶体的原因_________________。
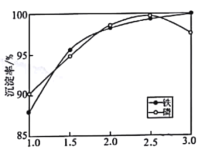
②一定条件下,探究了pH对磷酸铁沉淀的影响,结果如图所示。由图可知,过程Ⅲ应选取的最佳沉淀pH为____。随pH的增加,磷的沉淀率开始下降,而铁沉淀率未下降,分析原因为_________________。
(4)测得滤液1中c(Li+)=0.l5mol/L,某同学取该100mL滤液进行“沉锂”反应.加入50mlNa2CO3溶液却未见沉淀,若不考虑Na2CO3的水解和液体混合时的体积变化,则该同学加入的Na2CO3溶液最大浓度为c(Na2CO3)=_____________mol/L
(5)过程Ⅵ将滤液2________,________,经过滤、干燥后得Na3PO4·12H2O晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于苯乙烯(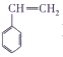 )有下列叙述,其中错误的是( )
)有下列叙述,其中错误的是( )
A.既可以与溴发生加成反应,又可以与溴发生取代反应
B.1mol苯乙烯最多可以与4mol氢气发生加成反应
C.苯乙烯分子中所有原子一定处于同一平面上
D.苯乙烯既可使酸性髙锰酸钾溶液褪色,又可使溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化加氢可生成2-甲基戊烷的是
A. CH2=CHC(CH3)2CH2CH3 B. CH2=CHCH(CH3)C≡CH
C. (CH3)2C=C(CH3)2 D. (CH3)2CHCH2C≡CH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com