
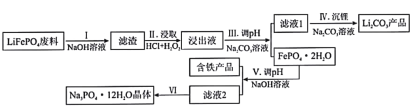
【题目】磷酸亚铁锂(LiFePO4)是目前使用量最多的一种锂电池电极材料,LiFePO4废料中(含Al、石墨)磷、铁、锂的综合回收工艺流程图:
已知:①![]() ,
,![]()
②常温下,![]() ,
,![]() ,
,![]()
(1)过程I“碱浸”的目的是____________,该过程发生反应的离子方程式为_________________。
(2)过程II“酸浸”加人双氧水的目的是_________________。
(3)①浸出液中存在大量![]() 、
、![]() 离子,从平衡移动角度解释过程Ⅲ得到磷酸铁晶体的原因_________________。
离子,从平衡移动角度解释过程Ⅲ得到磷酸铁晶体的原因_________________。
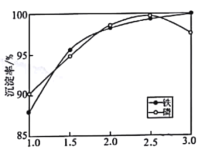
②一定条件下,探究了pH对磷酸铁沉淀的影响,结果如图所示。由图可知,过程Ⅲ应选取的最佳沉淀pH为____。随pH的增加,磷的沉淀率开始下降,而铁沉淀率未下降,分析原因为_________________。
(4)测得滤液1中c(Li+)=0.l5mol/L,某同学取该100mL滤液进行“沉锂”反应.加入50mlNa2CO3溶液却未见沉淀,若不考虑Na2CO3的水解和液体混合时的体积变化,则该同学加入的Na2CO3溶液最大浓度为c(Na2CO3)=_____________mol/L
(5)过程Ⅵ将滤液2________,________,经过滤、干燥后得Na3PO4·12H2O晶体。
【答案】溶解Al,使其分离出去 ![]() 将Fe2+氧化为Fe3+ CO32-结合H+,
将Fe2+氧化为Fe3+ CO32-结合H+,![]() ,
,![]() 两个平衡均向右移动,c(PO43-)增大,与Fe3+结合形成磷酸铁晶体 2.5 随pH的增加,部分FePO42H2O沉淀转变为Fe(OH)3沉淀,使得部分PO43-释放,导致磷沉淀率下降,而铁仍在沉淀中 0.51 蒸发浓缩 冷却结晶
两个平衡均向右移动,c(PO43-)增大,与Fe3+结合形成磷酸铁晶体 2.5 随pH的增加,部分FePO42H2O沉淀转变为Fe(OH)3沉淀,使得部分PO43-释放,导致磷沉淀率下降,而铁仍在沉淀中 0.51 蒸发浓缩 冷却结晶
【解析】
LiFePO4废料(含Al、石墨)加入氢氧化钠溶液,铝与氢氧化钠溶液反应生成可溶于水的NaAlO2,过滤,滤渣中含有LiFePO4和石墨,在滤渣中加入盐酸和过氧化氢浸取,可氧化亚铁离子生成铁离子,浸出液中含有铁离子、锂离子、![]() 、
、![]() 离子等,加入碳酸钠溶液调节pH,可生成FePO42H2O,滤液1中含有锂离子,滤液1中加入碳酸钠沉锂得到Li2CO3产品,FePO42H2O中加入氢氧化钠溶液调节pH,得到含铁产品和滤液2,滤液2为Na3PO4溶液,Na3PO4溶液再经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥后得Na3PO4·12H2O晶体。
离子等,加入碳酸钠溶液调节pH,可生成FePO42H2O,滤液1中含有锂离子,滤液1中加入碳酸钠沉锂得到Li2CO3产品,FePO42H2O中加入氢氧化钠溶液调节pH,得到含铁产品和滤液2,滤液2为Na3PO4溶液,Na3PO4溶液再经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥后得Na3PO4·12H2O晶体。
以此解答该题。
(1)铝与氢氧化钠溶液反应生成可溶于水的NaAlO2,则过程I“碱浸”的目的是溶解Al,使其分离出去,该过程发生反应的离子方程式为![]() ,故答案为:溶解Al,使其分离出去;
,故答案为:溶解Al,使其分离出去;![]() ;
;
(2)过程II“酸浸”加人双氧水的目的是将Fe2+氧化为Fe3+,故答案为:将Fe2+氧化为Fe3+;
(3)①浸出液中存在大量![]() 、
、![]() 离子,加入碳酸钠溶液后,CO32-结合H+,
离子,加入碳酸钠溶液后,CO32-结合H+,![]() ,
,![]() 两个平衡均向右移动,c(PO43-)增大,与Fe3+结合形成磷酸铁晶体;
两个平衡均向右移动,c(PO43-)增大,与Fe3+结合形成磷酸铁晶体;
②过程Ⅲ得到FePO42H2O,由图可知在pH等于2.5时,磷的沉淀率最高,则应选取的最佳沉淀pH为2.5,根据图像可知,随pH的增加,磷的沉淀率开始下降,而铁沉淀率未下降,是因为随pH的增加,部分FePO42H2O沉淀转变为Fe(OH)3沉淀,使得部分PO43-释放,导致磷沉淀率下降,而铁仍在沉淀中;
故答案为:2.5;随pH的增加,部分FePO42H2O沉淀转变为Fe(OH)3沉淀,使得部分PO43-释放,导致磷沉淀率下降,而铁仍在沉淀中;
(4)混合溶液中![]() ,设该同学加入的Na2CO3溶液的浓度为x mol/L,则混合溶液中
,设该同学加入的Na2CO3溶液的浓度为x mol/L,则混合溶液中![]() ,二者混合未见沉淀,则
,二者混合未见沉淀,则![]() ,解得
,解得
(5)滤液2为Na3PO4溶液,Na3PO4溶液再经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥后得Na3PO4·12H2O晶体,故答案为:蒸发浓缩;冷却结晶。


科目:高中化学 来源: 题型:
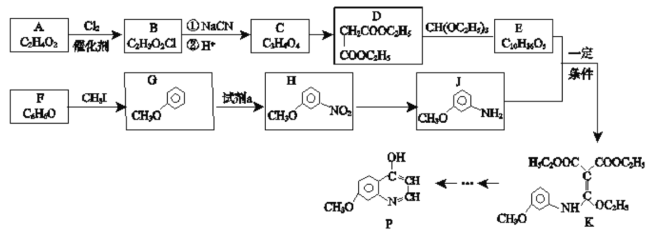
【题目】有机化合物P是合成抗肿瘤药物的中间体,其合成路线如下:
已知:RCl![]() RCOOH
RCOOH
(1)H的官能团名称___________。写出E的结构简式___________。
(2)B→C中①的化学方程式___________。
(3)检验F中官能团的试剂及现象_________。
(4)D的同分异构体有多种,其中满足以下条件的有________种。
①1mol D能与足量 NaHCO3反应放出2mol CO2
②核磁共振氢谱显示有四组峰
(5)H→J的反应类型___________。
(6)已知: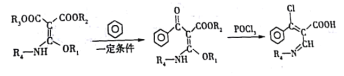
K经过多步反应最终得到产物P:
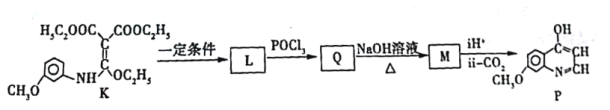
①K→L的化学方程式___________。
②写出M的结构简式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学工作者研发了一种 SUNCAT的系统,借助锂循环可持续,合成其原理如图所示。下列说法不正确的是
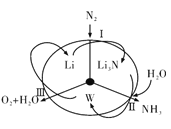
A. 过程I得到的Li3N的电子式为![]()
B. 过程Ⅱ生成W的反应为Li3N+3H2O=3LiOH+NH3↑
C. 过程Ⅲ涉及的阳极反应为4OH--4e-=O2↑+2H2O
D. 过程I、Ⅱ、Ⅲ均为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A,B,C,D,E,F均为周期表中前36号元素,且原子序数依次增大.A,B,C为同一周期的主族元素,B原子p能级电子总数与s能级电子总数相等.A,F原子未成对电子是同周期中最多的,且F基态原子中电子占据三种不同形状的原子轨道.D和E原子的第一至第四电离能如下表所示:
电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
D | 738 | 1451 | 7733 | 10540 |
E | 578 | 1817 | 2745 | 11578 |
(1)A,B,C三种元素的电负性最大的是__(填写元素符号),D,E两元素中D的第一电离能较大的原因是__.
(2)F基态原子的核外电子排布式是__;在一定条件下,F原子的核外电子从基态跃迁到激发态产生的光谱属于__光谱(填“吸收”或“发射”).
(3)根据等电子原理,写出AB+的电子式:__.
(4)已知:F3+可形成配位数为6的配合物.组成为FCl36H2O的配合物有3种,分别呈紫色、蓝绿色、绿色,为确定这3种配合物的成键情况,分别取等质量的紫色、蓝绿色、绿色3种物质的样品配成溶液,分别向其中滴入过量的AgNO3溶液,均产生白色沉淀且质量比为3:2:1.则绿色配合物的化学式为__.
A [CrCl(H2O)5]Cl2H2O B [CrCl2(H2O)4]Cl2H2O
C [Cr(H2O)6]Cl3 D [CrCl3(H2O)3]3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯氢的制备是目前的研究热点,利用太阳能光伏电池电解水制高纯氢,工作示意图如图所示。下列有关说法正确的是
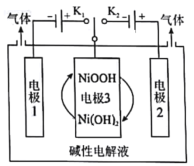
A.连接K1可以制取O2
B.电极2发生反应2H2O+2e-=H2↑+2OH-
C.电极3的主要作用是通过NiOOH和Ni(OH)2相互转化提供电子转移
D.连接K2溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A是农药生产中的一种中间体,其结构简式如下图所示。下列叙述正确的是

A. 有机物A可与溴水发生加成反应
B. 1mol有机物A能消耗2molNaOH
C. 有机物A不能使酸性高锰酸钾溶液褪色
D. 有机物A分子中所有碳原子可能在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯、甲醇等为原料合成有机物G的路线如下:
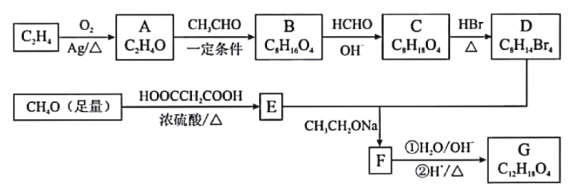
已知:①A分子中只有一种氢;B分子中有四种氢,且能发生银镜反应
②2HCHO+OH-→ CH3OH+HCOO-
③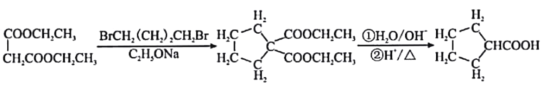
请回答下列问题:
(1)E的化学名称是__________________。
(2)F所含官能团的名称是___________________。
(3)A→B、C→D的反应类型分别是__________________、__________________。
(4)写出B→C的化学方程式__________________。
(5)G的结构简式为__________________。
(6)H是G的同分异构体,写出满足下列条件的H的结构简式__________________。
①1mol H与NaOH溶液反应可以消耗4molNaOH;
②H的核磁共振氢谱有四组峰,峰面积之比为6:1:1:1。
(7)由甲基苯乙醛和X经如图步骤可合成高聚酯L。
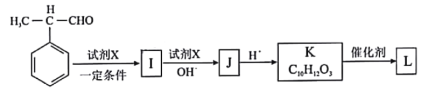
试剂X为________________;L的结构简式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四溴化钛(TiBr4)可用作橡胶工业中烯烃聚合反应的催化剂。已知TiBr4常温下为橙黄色固体,熔点为38.3℃,沸点为233.5℃,具有潮解性且易发生水解。实验室利用反应TiO2+C+2Br2![]() TiBr4+CO2制备TiBr4的装置如图所示。回答下列问题:
TiBr4+CO2制备TiBr4的装置如图所示。回答下列问题:
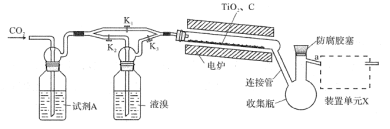
(1)检查装置气密性并加入药品后,加热前应进行的操作是__,其目的是__,此时活塞K1,K2,K3的状态为__;一段时间后,打开电炉并加热反应管,此时活塞K1,K2,K3的状态为____。
(2)试剂A为__,装置单元X的作用是__;反应过程中需用热源间歇性微热连接管,其目的是___。
(3)反应结束后应继续通入一段时间CO2,主要目的是___。
(4)将连接管切断并熔封,采用蒸馏法提纯。此时应将a端的仪器改装为__、承接管和接收瓶,在防腐胶塞上加装的仪器是___(填仪器名称)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com