
【题目】NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
(1)实验室用金属铜和稀硝酸制取NO的离子方程式为:__________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
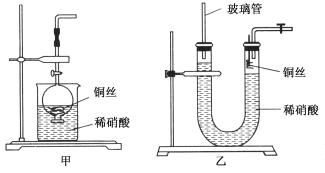
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填选项编号)。
A.铁B.铝C.铂D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是____________________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。长玻璃管的作用是______________________________________________。
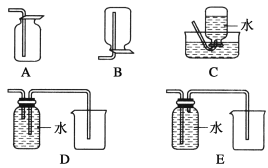
(4)以下收集NO气体的装置,合理的是________(填选项代号)。
(5)假设实验中12.8gCu全部溶解,需要通入标况下________LO2才能使NO全部溶于水。
(6)用金属铜制取硝酸铜,从节约原料和防止环境污染的角度考虑,下列4种方法中最好的是________(填“甲”、“乙”、“丙”或“丁”),理由是____________________________。
甲:铜+浓硝酸→硝酸铜
乙:铜+稀硝酸→硝酸铜
丙:铜+氯气→氯化铜;氯化铜+硝酸→硝酸铜
丁:铜+空气→氧化铜;氧化铜+硝酸→硝酸铜
【答案】3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑ C、D 2NO+O2===2NO2 接收被气体压出U形管的液体,防止稀硝酸溢出 C、D 2.24L 丁 制取相同质量的Cu(NO3)2,丁所消耗的HNO3的量最少(原料的利用率最高)且不产生污染环境的气体
【解析】
(1) 利用稀硝酸强氧化性,与铜发生反应,离子反应方程式为3Cu+8H++2NO3-=3Cu2++2 NO↑+4H2O;
(2) ①所用物质不能与稀硝酸反应,干扰铜和稀硝酸的反应,Fe、Al都与稀硝酸反应,Pt、玻璃不与稀硝酸反应,即选择C、D;
②分液漏斗中含有空气,NO与氧气反应生成红棕色的NO2,即2NO+O2=2NO2;
(3) 关闭活塞,铜丝与硝酸反应,气体增多,压强增大,会把硝酸压入到玻璃管中,防止稀硝酸溢出,所以长玻璃管的作用是:接收被气体压出U形管的液体,防止稀硝酸溢出
(4) 因为NO与空气中氧气反应,因此收集NO用排水法收集,排水法收集气体应是短管进气长管出水,因此选项C和D正确;
(5) NO与氧气、水的反应为:4NO+3O2+2H2O=4HNO3,铜的物质的量为![]() ,根据反应3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑,生成NO物质的量为
,根据反应3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑,生成NO物质的量为![]() ,根据反应4NO+3O2+2H2O=4HNO3,氧气物质的量为
,根据反应4NO+3O2+2H2O=4HNO3,氧气物质的量为![]() ,得V(O2)=2.24L;
,得V(O2)=2.24L;
(6) .甲:铜与浓硝酸反应产生对环境有污染的氮的氧化物,故甲错误;乙:产生NO,污染空气,故乙错误;丙:使用氯气,氯气有毒,污染空气,故丙错误;丁:对环境无污染,故丁正确,同时根据几个反应可以看出制取相同质量的Cu(NO3)2,丁所消耗的HNO3的量最少,所以最好的是丁,理由是制取相同质量的Cu(NO3)2,丁所消耗的HNO3的量最少(原料的利用率最高)且不产生污染环境的气体。


科目:高中化学 来源: 题型:
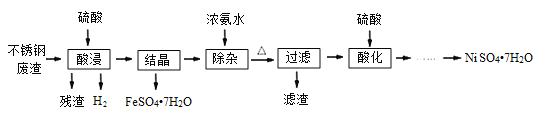
【题目】硫酸镍是电镀工业必不可少的化工原料。从不锈钢废渣(主要含Fe42.35%、Cr9.67%、Ni5.1%、C4.7%、Si3.39%等)中制取硫酸镍晶体的工艺流程如图:
 已知:①Cr3+与氨水反应时有少量Cr3+生成[Cr(NH3)6]3+,但加热时该络合物易分解。Ni2+与氨水反应生成[Ni(NH3)6]2+,该络合物加热时稳定,用硫酸酸化时生成相应的硫酸盐。
已知:①Cr3+与氨水反应时有少量Cr3+生成[Cr(NH3)6]3+,但加热时该络合物易分解。Ni2+与氨水反应生成[Ni(NH3)6]2+,该络合物加热时稳定,用硫酸酸化时生成相应的硫酸盐。
②Na2CrO4溶液中加酸调节pH为3.5时,CrO42-转化为Cr2O72-。
③相关物质在不同温度时溶解度如下表:
温度 溶解度/g 物质 | 20℃ | 30℃ | 40℃ | 60℃ | 80℃ | 90℃ |
Na2SO4 | 19.5 | 40.8 | 48.8 | 45.3 | 43.7 | 42.7 |
Na2Cr2O7 | 183 | 198 | 215 | 269 | 376 | 405 |
(1)“酸浸”后得到的溶液中主要含有FeSO4、NiSO4、Cr2(SO4)3,生成NiSO4的化学方程式为___。“酸浸”时需控制温度为90℃左右,可以采用的加热方式是___。
(2)“过滤”前,适当加热的目的是___。
(3)对“过滤”所得的滤渣进行洗涤,检验滤渣已洗涤干净的方法是___。
(4)“过滤”时产生的滤渣可用于制备Na2Cr2O7晶体。
①滤渣经干燥后与Na2CO3混合在空气中煅烧生成Na2CrO4和CO2,此反应的化学方程式为___。
②请补充完整上述煅烧后混合物制备Na2Cr2O7晶体(橙红色)的实验方案:水浸,过滤,___,烘干得Na2Cr2O7晶体(必须使用的试剂有:硫酸,蒸馏水)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知原子序数,可能推断原子的
①质子数 ②中子数 ③质量数 ④核电荷数 ⑤核外电子数
⑥原子结构示意图 ⑦元素在周期表中的位置
A. ①②③④⑥ B. ①④⑤⑥⑦
C. ②③④⑤⑦ D. ③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
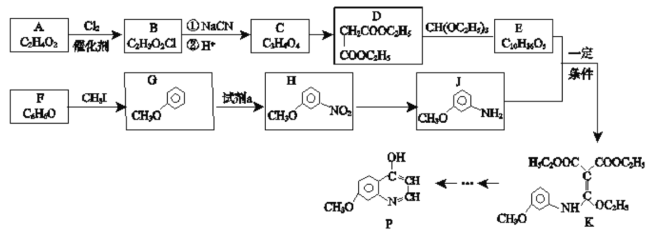
【题目】有机化合物P是合成抗肿瘤药物的中间体,其合成路线如下:
已知:RCl![]() RCOOH
RCOOH
(1)H的官能团名称___________。写出E的结构简式___________。
(2)B→C中①的化学方程式___________。
(3)检验F中官能团的试剂及现象_________。
(4)D的同分异构体有多种,其中满足以下条件的有________种。
①1mol D能与足量 NaHCO3反应放出2mol CO2
②核磁共振氢谱显示有四组峰
(5)H→J的反应类型___________。
(6)已知: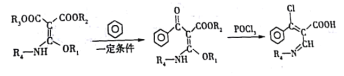
K经过多步反应最终得到产物P:
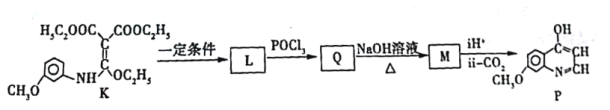
①K→L的化学方程式___________。
②写出M的结构简式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯仿(CHCl3)常因保存不慎而被氧化,产生剧毒物光气(COCl2):2CHCl3+O2―→2HCl +2COCl2。下列说法不正确的有

A. CHCl3分子的空间构型为正四面体
B. COCl2分子中中心C原子采用sp2杂化
C. COCl2分子中所有原子的最外层电子都满足8电子稳定结构
D. 使用前可用硝酸银稀溶液检验氯仿是否变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为_______nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)基态K原子中,核外电子占据的最高能层的符号是_________,占据该能层电子的电子云轮廓图形状为___________。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是___________________________。
(3)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为_____________,中心原子的杂化形式为________________。
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为______nm,与K紧邻的O个数为__________。
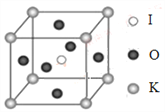
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe 三种金属元素组成,回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_______方法区分晶体、准晶体和非晶体。
(2)基态 Fe原子有_______个未成对电子,Fe3+的电子排布式为 _____,可用硫氰化钾检验Fe3+,形成的配合物的颜色为________ 。
(3)新制备的Cu(OH)2可将乙醛〔CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道类型为____________,乙酸的沸点明显高于乙醛,其主要原因是________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有_______个铜原子。
(4)Al单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为_____ 。列式表示Al单质的密度___________g·cm-3(不必计算出结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学工作者研发了一种 SUNCAT的系统,借助锂循环可持续,合成其原理如图所示。下列说法不正确的是
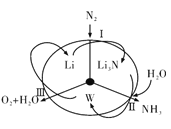
A. 过程I得到的Li3N的电子式为![]()
B. 过程Ⅱ生成W的反应为Li3N+3H2O=3LiOH+NH3↑
C. 过程Ⅲ涉及的阳极反应为4OH--4e-=O2↑+2H2O
D. 过程I、Ⅱ、Ⅲ均为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯、甲醇等为原料合成有机物G的路线如下:
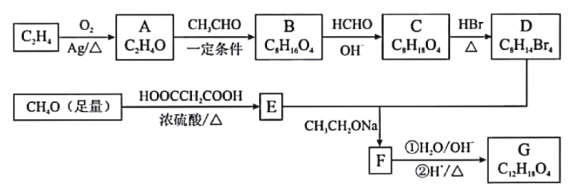
已知:①A分子中只有一种氢;B分子中有四种氢,且能发生银镜反应
②2HCHO+OH-→ CH3OH+HCOO-
③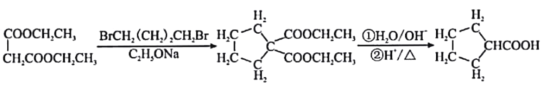
请回答下列问题:
(1)E的化学名称是__________________。
(2)F所含官能团的名称是___________________。
(3)A→B、C→D的反应类型分别是__________________、__________________。
(4)写出B→C的化学方程式__________________。
(5)G的结构简式为__________________。
(6)H是G的同分异构体,写出满足下列条件的H的结构简式__________________。
①1mol H与NaOH溶液反应可以消耗4molNaOH;
②H的核磁共振氢谱有四组峰,峰面积之比为6:1:1:1。
(7)由甲基苯乙醛和X经如图步骤可合成高聚酯L。
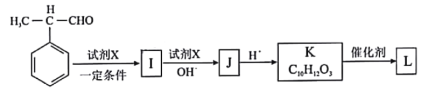
试剂X为________________;L的结构简式为________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com