
【题目】有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如图示的装置进行试验。通入二氧化硫气体,将带余烬的木条插入试管中,木条复燃。
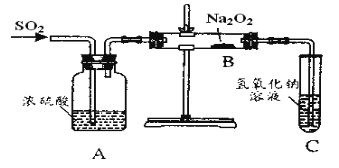
请回答下列问题:
(1)第一小组同学认为Na2O2与SO2反应生成的白色固体中含有Na2SO3和O2该反应的化学方程式为___。
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3___。
(3)第二小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:
将B中反应后的固体溶解于水(再加BaCl2溶液)→白色沉淀→(加入稀硝酸)仍有部分白色沉淀不溶解,证明有Na2SO4生成。上述方案是否合理?___;请简要说明理由:__。
(4)在100mL混合溶液中,HNO3和H2SO4的物质的量浓度分别是0.4mol/L,0.1mol/L向该混合液中加入1.92g铜粉,加热待充分反应后,所得溶液中Cu2+的物质的量浓度是__(填选项字母)。
A.0.15 B.0.225 C.0.35 D.0.45
【答案】2Na2O2+2SO2=2Na2SO3+O2 取白色固体加入稀H2SO4,若产生能使品红溶液褪色的气体,则白色固体中含有Na2SO3 不合理 稀HNO3具有氧化性,可将BaSO3氧化成BaSO4(或者如果反应后的固体,它溶于水后能将亚硫酸根离子氧化成硫酸根离子) B
【解析】
(1)探究Na2O2与SO2的反应,由实验装置可知,浓硫酸干燥SO2,通入SO2气体,再用NaOH吸收尾气;
(2)可利用强酸制弱酸的反应原理检验Na2SO3,向反应后的溶液中滴加盐酸,再将生成的气体通入品红溶液中,若褪色则有SO2生成,原固体中含有Na2SO3;
(3)检验Na2SO4时,需排除Na2SO3的干扰,因为Na2SO3易被氧化成Na2SO4;硝酸、Na2O2氧化性均很强,均能将SO32-氧化成SO42-;
(4)Cu和HNO3、H2SO4构成的混合酸反应,可利用离子方程式计算。
(1)SO2与Na2O2反应生成Na2SO3和O2,化学方程式为2Na2O2+2SO2=2Na2SO3+O2;
(2)Na2SO3可与稀硫酸反应生成SO2,通过检验SO2来检验Na2SO3;实验操作为取白色固体加入稀H2SO4,若产生能使品红溶液褪色的气体,则白色固体中含有Na2SO3;
(3)SO32-能被硝酸氧化成SO42-,也能生成不溶于酸的白色沉淀;此外,反应中未反应完的Na2O2也具有强氧化性,也能氧化SO32-;答案为不合理,稀HNO3具有氧化性,可将BaSO3氧化成BaSO4(或者如果反应后的固体,它溶于水后能将亚硫酸根离子氧化成硫酸根离子);
(4)100mL混合溶液中,HNO3和H2SO4的浓度分别是0.4mol·L-1、0.1mol·L-1,则n(NO3-)=0.1L×0.4mol·L-1=0.04mol;n(H+)=0.1L×0.4mol·L-1+0.1L×0.1mol·L-1×2=0.06mol,1.92gCu的物质的量n(Cu)=![]() 。Cu和混合酸反应的离子方程式为3Cu+8H+2NO3-=3Cu2++2NO↑+4H2O,根据离子方程式可知,H+的量不足,根据H+的量计算。可得关系式8H+~3Cu2+,n(H+)=0.6mol,则n(Cu2+)=
。Cu和混合酸反应的离子方程式为3Cu+8H+2NO3-=3Cu2++2NO↑+4H2O,根据离子方程式可知,H+的量不足,根据H+的量计算。可得关系式8H+~3Cu2+,n(H+)=0.6mol,则n(Cu2+)=![]() ,则c(Cu2+)=
,则c(Cu2+)=![]() 。
。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】科学工作者研发了一种 SUNCAT的系统,借助锂循环可持续,合成其原理如图所示。下列说法不正确的是
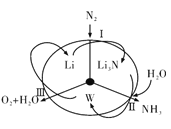
A. 过程I得到的Li3N的电子式为![]()
B. 过程Ⅱ生成W的反应为Li3N+3H2O=3LiOH+NH3↑
C. 过程Ⅲ涉及的阳极反应为4OH--4e-=O2↑+2H2O
D. 过程I、Ⅱ、Ⅲ均为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯、甲醇等为原料合成有机物G的路线如下:
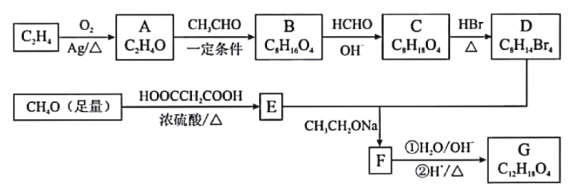
已知:①A分子中只有一种氢;B分子中有四种氢,且能发生银镜反应
②2HCHO+OH-→ CH3OH+HCOO-
③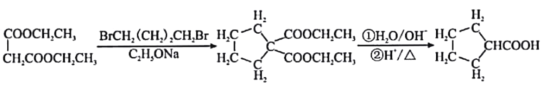
请回答下列问题:
(1)E的化学名称是__________________。
(2)F所含官能团的名称是___________________。
(3)A→B、C→D的反应类型分别是__________________、__________________。
(4)写出B→C的化学方程式__________________。
(5)G的结构简式为__________________。
(6)H是G的同分异构体,写出满足下列条件的H的结构简式__________________。
①1mol H与NaOH溶液反应可以消耗4molNaOH;
②H的核磁共振氢谱有四组峰,峰面积之比为6:1:1:1。
(7)由甲基苯乙醛和X经如图步骤可合成高聚酯L。
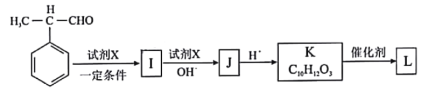
试剂X为________________;L的结构简式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g)![]() CH3OH(g) △H 1=-90.7 kJ·mol-1
CH3OH(g) △H 1=-90.7 kJ·mol-1
② 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
③ CO(g)+H2O(g)![]() CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
回答下列问题:
(1)反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g) △H=____kJ·mol-1。
CH3OCH3(g)+CO2(g) △H=____kJ·mol-1。
下列措施中,能提高CH3OCH3产率的有____。
A.使用合适的催化剂 B.升高温度 C.增大压强
(2)将合成气以n(H2)/n(CO)=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是____。
CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是____。
A.△H < 0
B.P1<P2<P3
C.若在P3和316℃时,起始n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%

(3)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚。观察图2回答问题。催化剂中n(Mn)/n(Cu)约为____时最有利于二甲醚的合成。
(4)图3为绿色电源“二甲醚燃料电池”的工作原理示意图,b电极的电极反应式为____。
(5)甲醇液相脱水法制二甲醚的原理是:
CH3OH +H2SO4 → CH3HSO4+H2O,
CH3 HSO4+CH3OH → CH3OCH3+H2SO4。
与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质) 制取七水合硫酸亚铁(FeSO4·7H2O) ,流程如下:

(1)浸取时,溶液中的Fe2+易被空气中的O2氧化,其离子方程式为 。能提高烧渣浸取速率的措施有 (填字母)。
A.将烧渣粉碎 B.降低硫酸的浓度 C.适当升高温度
(2)还原时,试剂X的用量与溶液pH的变化如图所示,则试剂X可能是 (填字母)。

A.Fe粉 B.SO2 C.NaI
还原结束时,溶液中的主要阴离子有 。
(3)滤渣Ⅱ主要成分的化学式为 ;由分离出滤渣Ⅱ后的溶液得到产品,进行的操作是 、 过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阳极泥处理后的沉渣中含AgCl,工业上可用Na2SO3溶液作浸取剂浸出回收。某小组在实验室模拟该过程。
已知:
i.25oC时,部分物质的溶解度:AgCl 1.9×10–4 g;Ag2SO3 4.6×10–4 g;Ag2SO4 0.84 g。
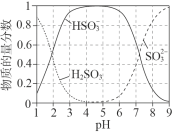
ii.25oC时,亚硫酸钠溶液酸化过中含![]() 微粒的物质的量分数随pH变化如图所示。
微粒的物质的量分数随pH变化如图所示。
Ⅰ.浸出氯化银
取AgCl固体,加入1 mol/L Na2SO3溶液作浸取剂,充分反应后过滤得到浸出液(pH=8),该过程中发生的反应为AgCl +![]()
![]() [Ag(SO3)2]3– + Cl–。
[Ag(SO3)2]3– + Cl–。
(1)用平衡移动原理解释AgCl溶解的原因是___。
Ⅱ. 酸化沉银
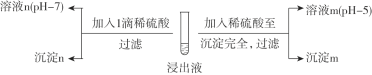
(2)经检测,沉淀m为AgCl,则溶液m中含![]() 微粒的主要存在形式是________。
微粒的主要存在形式是________。
(3)探究沉淀n的成分。
①甲同学认为沉淀n一定不含Ag2SO4,其依据是________。
②乙同学认为沉淀n可能含Ag2SO3,进行实验验证。
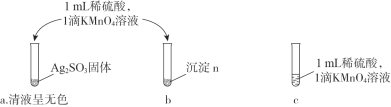
i. 本实验设计的依据是:Ag2SO3具有________性。
ii. 乙同学观察到________,得出结论“沉淀n不含Ag2SO3”。
③丙同学从溶液n的成分角度再次设计实验证明沉淀n不含Ag2SO3。

i. 本实验设计的依据是:若沉淀n含Ag2SO3,则溶液n中含![]() 微粒的总物质的量___(填“>”、“=”或“<”)Cl–物质的量。
微粒的总物质的量___(填“>”、“=”或“<”)Cl–物质的量。
ii. 结合实验现象简述丙同学的推理过程:____。
Ⅲ.浸取剂再生
(4)溶液m经处理后可再用于浸出AgCl,请简述该处理方法____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四溴化钛(TiBr4)可用作橡胶工业中烯烃聚合反应的催化剂。已知TiBr4常温下为橙黄色固体,熔点为38.3℃,沸点为233.5℃,具有潮解性且易发生水解。实验室利用反应TiO2+C+2Br2![]() TiBr4+CO2制备TiBr4的装置如图所示。回答下列问题:
TiBr4+CO2制备TiBr4的装置如图所示。回答下列问题:
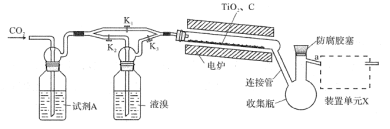
(1)检查装置气密性并加入药品后,加热前应进行的操作是__,其目的是__,此时活塞K1,K2,K3的状态为__;一段时间后,打开电炉并加热反应管,此时活塞K1,K2,K3的状态为____。
(2)试剂A为__,装置单元X的作用是__;反应过程中需用热源间歇性微热连接管,其目的是___。
(3)反应结束后应继续通入一段时间CO2,主要目的是___。
(4)将连接管切断并熔封,采用蒸馏法提纯。此时应将a端的仪器改装为__、承接管和接收瓶,在防腐胶塞上加装的仪器是___(填仪器名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式正确的是( )
A.小苏打与盐酸反应的离子方程式:CO32+H+=CO2↑+H2O
B.乙烯与氯化氢加成的化学方程式:CH2=CH2+HCl![]() CH3=CH2Cl
CH3=CH2Cl
C.碳酸钾在水中的电离方程式:K2CO3![]() 2K++CO32
2K++CO32
D.醋酸钠水解的离子方程式:CH3COO+H2O![]() CH3COOH+OH
CH3COOH+OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com