
【题目】氢气是重要的清洁能源。科学家尝试多种方法制取氢气。
I.(1)储氢材料![]() 能与水反应得到氢气。请写出
能与水反应得到氢气。请写出![]() 的电子式______________,该反应的化学方程式为______________________________。
的电子式______________,该反应的化学方程式为______________________________。
Ⅱ.甘油和水蒸气、氧气经催化重整或部分催化氧化可制得氢气,反应主要过程如下:
甘油水蒸气重整( |
|
甘油部分氧化( |
|
甘油氧化水蒸汽重整( |
|
(2)反应![]() 的H1=_____ kJmol-1。
的H1=_____ kJmol-1。
(3)实际生产中将反应![]() 设定在600~700℃进行,选择该温度范围的原因是:________________。
设定在600~700℃进行,选择该温度范围的原因是:________________。
(4)反应![]() 的副产物很多,加入一定量的
的副产物很多,加入一定量的![]() 通入适当过量的
通入适当过量的![]() 都能提高氢气的产率。则加入
都能提高氢气的产率。则加入![]() 的原因:___________________;若混合气体中,
的原因:___________________;若混合气体中,![]() 比例过高,则
比例过高,则![]() 产率降低,其原因是:____________________________。
产率降低,其原因是:____________________________。
(5)通常将![]() 分散在高比表面的载体(
分散在高比表面的载体(![]() )上以提高催化效率。分别用三种催化剂的载体进行实验,持续通入原料气一段时间,绘制油转化率与时间的关系如图所示。
)上以提高催化效率。分别用三种催化剂的载体进行实验,持续通入原料气一段时间,绘制油转化率与时间的关系如图所示。

①结合上图分析![]() 催化剂具有的优点是____________________。
催化剂具有的优点是____________________。
②研究发现造成催化效率随时间下降的主要原因是副反应产生的大量碳粉(积碳)包裹催化剂,通过加入微量的、可循环利用的氧化镧(![]() )可有效减少积碳。其反应机理包括两步:
)可有效减少积碳。其反应机理包括两步:
第一步为:![]()
第二步为:___________________________(写出化学反应方程式)。
【答案】Na+[:H]- NaH+H2O=NaOH+H2↑ +128 催化剂活性和选择性高、升高温度反应速率加快 CaO结合CO2生成CaCO3,使反应Ⅰ平衡正向移动,H2产率提高 甘油直接燃烧不产生H2,或过量O2会与H2反应 催化效率高,稳定性高(或催化剂寿命长) La2O2CO3+C=La2O3+2CO↑
【解析】
I.(1)NaH由Na+和H-构成,电子式为Na+[:H]-,NaH与水反应,生成NaOH和H2,该反应的化学方程式为NaH+H2O=NaOH+H2↑。答案为:Na+[:H]-;NaH+H2O=NaOH+H2↑;
Ⅱ.(2)![]() H2=-1206kJmol-1 ①
H2=-1206kJmol-1 ①
![]() H3=-950kJmol-1 ②
H3=-950kJmol-1 ②
利用盖斯定律,将(②-①)×![]() ,得
,得![]() H1=+128kJmol-1。答案为:+128;
H1=+128kJmol-1。答案为:+128;
(3)实际生产中将反应![]() 设定在600~700℃进行,选择该温度范围,主要从催化剂的活性和温度对反应速率的影响考虑,其原因是:催化剂活性和选择性高、升高温度反应速率加快;
设定在600~700℃进行,选择该温度范围,主要从催化剂的活性和温度对反应速率的影响考虑,其原因是:催化剂活性和选择性高、升高温度反应速率加快;
(4)加入CaO,可吸收产物中的CO2生成CaCO3,使反应Ⅰ平衡正向移动,H2产率提高;若混合气体中,![]() 比例过高,则
比例过高,则![]() 产率降低,其原因是:甘油直接燃烧不产生H2,或过量O2会与H2反应。答案为:CaO结合CO2生成CaCO3,使反应Ⅰ平衡正向移动,H2产率提高;甘油直接燃烧不产生H2,或过量O2会与H2反应;
产率降低,其原因是:甘油直接燃烧不产生H2,或过量O2会与H2反应。答案为:CaO结合CO2生成CaCO3,使反应Ⅰ平衡正向移动,H2产率提高;甘油直接燃烧不产生H2,或过量O2会与H2反应;
(5)①从图中可以看出,随着时间的延长,其催化效率基本不变,所以![]() 催化剂具有的优点是催化效率高,稳定性高(或催化剂寿命长)。答案为:催化效率高,稳定性高(或催化剂寿命长);
催化剂具有的优点是催化效率高,稳定性高(或催化剂寿命长)。答案为:催化效率高,稳定性高(或催化剂寿命长);
②题中强调氧化镧可循环利用,则应分解生成La2O3,反应方程式为La2O2CO3+C=La2O3+2CO↑。答案为:La2O2CO3+C=La2O3+2CO↑。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在 2A(g)+B(g)=3C(g)+4D(g)中,表示该反应最快的是( )
A.ν(A)=0.5mol/(L·s)B.ν(B)=0.3 mol/(L·s)
C.ν(C)=0.8 mol/(L·s)D.ν(D)=1 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如图:
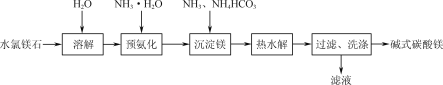
(1)为提高溶解速率,可以采取的措施有__(写一条)。
(2)检验碱式碳酸镁是否洗净的操作为___。
(3)预氨化过程中有Mg(OH)2沉淀生成,该过程发生反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C变化如图所示。
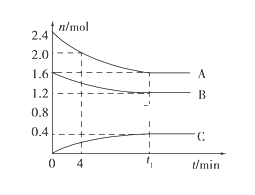
(1)写出该反应的化学方程式:___________;
(2)该温度下该反应的平衡常数为(保留两位有效数字)_______;
(3)已知:K(300℃)>K(350℃),该反应是________热反应;
(4)0~4分钟时,A的平均反应速率为____________;
(5)到达平衡时B的转化率为____________;
(6)恒容条件下,下列措施中能使![]() 降低的有__________。
降低的有__________。
A 充入氦气 B 使用催化剂
C 再充入2.4mol A和1.6mol B D 降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超临界状态下的CO2流体溶解性与有机溶剂相似,可提取中药材的有效成分,工艺流程如下。
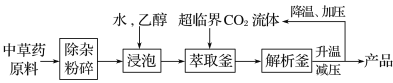
下列说法中错误的是( )
A.浸泡时加入乙醇有利于中草药有效成分的浸出
B.高温条件下更有利于超临界CO2流体萃取
C.升温、减压的目的是实现CO2与产品分离
D.超临界CO2流体萃取中药材具有无溶剂残留、绿色环保等优点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】枸橼酸( )是一种弱有机酸,是柑橘类水果中产生的一种天然防腐剂,也是食物和饮料中的酸味添加剂。
)是一种弱有机酸,是柑橘类水果中产生的一种天然防腐剂,也是食物和饮料中的酸味添加剂。
(1)枸橼酸属于____(填“无机化合物”或“有机化合物”)。
(2)枸橼酸中含氧官能团有羧基和____(填名称)。
(3)向枸橼酸溶液中滴入2~3滴紫色石蕊试液,溶液颜色变红,说明枸橼酸溶液具有____性。
(4)1 mol枸橼酸最多消耗____mol NaOH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A原子和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在加热下与足量的B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物。试根据以上叙述回答:
(1)元素名称:A_____,B______,C_______。
(2)D元素位于周期表中第_____周期_____族,它的最高价氧化物对应的水化物的化学式是_____________________。
(3)写出AB2与C2B2反应的化学方程式:____________。
(4)写出A单质与D元素的最高价氧化物对应水化物的浓溶液共热反应的化学方程式:___。若要设计实验验证该反应产物,则验证的产物顺序是_______(填写产物的化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研团队研究将磷钨酸(H3PW12O40,以下简称HPW)代替浓硫酸作为酯化反应的催化剂,但HPW自身存在比表面积小、易溶于有机溶剂而难以重复使用等缺点,将其负载在多孔载体(如硅藻土、C等)上则能有效克服以上不足,提高其催化活性。用HPW负载在硅藻土上催化制取乙酸正丁酯的酯化率与HPW负载量的关系(温度:120℃,时间:2h)如图所示,下列说法不正确的是
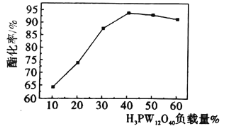
A.与HPW相比,HPW/硅藻土比表面积显著增加,有助于提高其催化性能
B.当HPW负载量为40%时达到饱和,酯化率最高
C.用HPW/硅藻土代替传统催化剂,可减少设备腐蚀等不足
D.不同催化剂对酯化率的影响程度主要取决于化学反应正向进行的程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的两种或多种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积)。关于该固体混合物,下列说法正确的是

A. 一定含有Al,其质量为4.05g
B. 一定不含FeCl2,可能含有MgCl2和AlCl3
C. 一定含有MgCl2 和FeCl2
D. 一定含有(NH4)2SO4 和MgCl2,且物质的量相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com