
����Ŀ����A��B��C��D���ֶ�����Ԫ�أ����ǵ�ԭ��������A��D����������֪Aԭ�Ӻ�Bԭ������ͬ�ĵ��Ӳ�������A��L���������K���������������C�ڿ�����ȼ��ʱ���ֻ�ɫ���棬C�ĵ����ڼ�������������B�ĵ��ʳ�ַ�Ӧ�����Եõ���D������ɫ��ͬ�ĵ���ɫ��̬������Ը������������ش�:
(1)Ԫ�����ƣ�A_____��B______��C_______��
(2)DԪ��λ�����ڱ��е�_____����_____��,��������������Ӧ��ˮ����Ļ�ѧʽ��_____________________��
(3)д��AB2��C2B2��Ӧ�Ļ�ѧ����ʽ��____________��
(4)д��A������DԪ�ص�����������Ӧˮ�����Ũ��Һ���ȷ�Ӧ�Ļ�ѧ����ʽ��___����Ҫ���ʵ����֤�÷�Ӧ����,����֤�IJ���˳����_______(��д����Ļ�ѧʽ)��
���𰸡�̼ �� �� �� ��A H2SO4 2CO2+2Na2O2=2Na2CO3+O2 C+2H2SO4(Ũ)![]() CO2��+2SO2��+2H2O H2O��SO2��CO2
CO2��+2SO2��+2H2O H2O��SO2��CO2
��������
A��B��C��D���ֶ�����Ԫ�أ����ǵ�ԭ��������A��D��������Aԭ�Ӻ�Bԭ������ͬ�ĵ��Ӳ�������A��B����ͬһ���ڣ���A��L���������K�����������������L�������Ϊ4����AΪ̼Ԫ�أ�C����ȼ��ʱ���ֻ�ɫ���棬��CΪ��Ԫ�أ�C�ĵ����ڵ�ȼʱ��������B���ʳ�ַ�Ӧ�����Եõ���D������ɫ��ͬ�ĵ���ɫ��̬�������BΪ��Ԫ�أ�DΪ��Ԫ�أ��ݴ˷������
(1)�����Ϸ�����֪��AΪ̼��BΪ����CΪ�ƣ�
(2)DΪSԪ�أ�ԭ�Ӻ�����3�����Ӳ㣬����������Ϊ6��Ӧλ�����ڱ��������ڵ���A�壬����������Ӧˮ����Ļ�ѧʽ��H2SO4��
(3)CO2��������Ʒ�Ӧ����̼��������������Ӧ�Ļ�ѧ����ʽΪ2CO2+2Na2O2=2Na2CO3+O2��
(4)̼��Ũ�����ڼ��ȵ������·�Ӧ���ɶ�����̼�����������ˮ������ʽΪC+2H2SO4(Ũ) ![]() CO2��+2SO2��+2H2O�����ں�������Ҫͨ����Һ���������ȼ���ˮ��������������Ҳ��ʹ����ʯ��ˮ����ǣ���ڶ���Ӧ����Ʒ����Һ����������������������Ժ����ó���ʯ��ˮ���������̼����������Ⱥ�˳����H2O��SO2��CO2��
CO2��+2SO2��+2H2O�����ں�������Ҫͨ����Һ���������ȼ���ˮ��������������Ҳ��ʹ����ʯ��ˮ����ǣ���ڶ���Ӧ����Ʒ����Һ����������������������Ժ����ó���ʯ��ˮ���������̼����������Ⱥ�˳����H2O��SO2��CO2��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����Ȼ�ѧ��Ӧ����������ȷ����
A. HCl��NaOH��Ӧ���к��ȡ�H����57.3 kJ��mol1����H2SO4��Ca(OH)2��Ӧ���к��ȡ�H=2��(��57.3)kJ��mol1
B. ����ı�ȼ���Ȧ�H����890.3 kJ��mol1����CH4(g)��2O2(g)��CO2(g)��2H2O(g) ��H����890.3 kJ��mol1
C. ��֪��500�桢30MPa�£�N2(g)��3H2(g)![]() 2NH3(g) ��H����92.4kJ��mol��1����1.5 mol H2������N2�ڴ������³�ַ�Ӧ���ų�����46.2 kJ
2NH3(g) ��H����92.4kJ��mol��1����1.5 mol H2������N2�ڴ������³�ַ�Ӧ���ų�����46.2 kJ
D. CO(g)��ȼ������283.0kJ��mol1����2CO2(g) ===2CO(g)+O2(g)��Ӧ�ġ�H��+566.0 kJ��mol1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.c(H+)��![]() ����Һһ��������
����Һһ��������
B.��ˮ���ȣ�KW����pH���䣬�Գ�����
C.��ˮ�м�������̼�����ƹ��壬��Һ��c(H+) ����KW����
D.��0.1mol��L-1������Һ�м�ˮ����Һ��ˮ���������c(H+)����С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ҫ�������Դ����ѧ�ҳ��Զ��ַ�����ȡ������
I��(1)�������![]() ����ˮ��Ӧ�õ���������д��
����ˮ��Ӧ�õ���������д��![]() �ĵ���ʽ______________���÷�Ӧ�Ļ�ѧ����ʽΪ______________________________��
�ĵ���ʽ______________���÷�Ӧ�Ļ�ѧ����ʽΪ______________________________��
���ͺ�ˮ�������������������ִ��������Ƶ���������Ӧ��Ҫ�������£�
����ˮ��������( |
|
���Ͳ�������( |
|
��������ˮ��������( |
|
(2)��Ӧ![]() ��H1=_____ kJmol-1��
��H1=_____ kJmol-1��
(3)ʵ�������н���Ӧ![]() �趨��600��700����У�ѡ����¶ȷ�Χ��ԭ���ǣ�________________��
�趨��600��700����У�ѡ����¶ȷ�Χ��ԭ���ǣ�________________��
(4)��Ӧ![]() �ĸ�����ܶ࣬����һ������
�ĸ�����ܶ࣬����һ������![]() ͨ���ʵ�������
ͨ���ʵ�������![]() ������������IJ��ʡ������
������������IJ��ʡ������![]() ��ԭ��___________________������������У�
��ԭ��___________________������������У�![]() �������ߣ���
�������ߣ���![]() ���ʽ��ͣ���ԭ���ǣ�____________________________��
���ʽ��ͣ���ԭ���ǣ�____________________________��
(5)ͨ����![]() ��ɢ�ڸ߱ȱ��������(
��ɢ�ڸ߱ȱ��������(![]() )������ߴ�Ч�ʡ��ֱ������ִ������������ʵ�飬����ͨ��ԭ����һ��ʱ�䣬������ת������ʱ��Ĺ�ϵ��ͼ��ʾ��
)������ߴ�Ч�ʡ��ֱ������ִ������������ʵ�飬����ͨ��ԭ����һ��ʱ�䣬������ת������ʱ��Ĺ�ϵ��ͼ��ʾ��

�ٽ����ͼ����![]() �������е��ŵ���____________________��
�������е��ŵ���____________________��
���о�������ɴ�Ч����ʱ���½�����Ҫԭ���Ǹ���Ӧ�����Ĵ���̼��(��̼)����������ͨ���������ġ���ѭ�����õ�������(![]() )����Ч���ٻ�̼���䷴Ӧ��������������
)����Ч���ٻ�̼���䷴Ӧ��������������
��һ��Ϊ��![]()
�ڶ���Ϊ��___________________________(д����ѧ��Ӧ����ʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ����ȷ����(��)
A.CuO��ϡ���ᷴӦ��CuO+2H+=Cu2++H2O
B.BaCl2��Һ��CuSO4��Һ��Ӧ��Ba2++S![]() =BaSO4��
=BaSO4��
C.Fe��ϡH2SO4��Ӧ��Fe+2H+=Fe2++H2��
D.����������Һ�����ᷴӦ��OH-+HCl=H2O+Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��C��N��S �������ﳣ�����һЩ�������⣬���й����������о��ø��ֻ�ѧ������������Щ���ʶԻ�����Ӱ�졣
(1)CO2 �������� CO2 �� H2 Ϊԭ�Ͽɵõ� CH4 ȼ�ϡ�
��֪: ��CH4 (g)+CO2(g)=2CO(g)+2H2(g) ��H1=+247kJ/mol
��CH4 (g)+H2O(g)=CO(g)+3H2(g) ��H2=+205kJ/mol
д�� CO2 �������Ȼ�ѧ����ʽ��_____��
(2) ����̼���η����������е� SO2
�ٽ�����ͨ�� 1.0mol/L �� Na2SO3 ��Һ�����˹�������Һ������䣬����Һ�� pH ����_____(������С���������� ��������)������Һ pH ԼΪ 6 ʱ������ SO2 �����������½���Ӧ�������ռ�����ʱ��Һ�� c(SO32-) =0.2mol/L�� ����Һ�� c(HSO3-) =_____��
�����������£�������ͨ��(NH4)2SO3 ��Һ�У������Һ pH ���������ʵ��������ı仯��ϵ��ͼ: b ��ʱ��Һ pH=7���� n(NH4+)��n(HSO3��)= ______________ ��

(3)��������ȥ�� NO��һ�������£��� NH3 ���� NO ��Ⱦ���䷴Ӧԭ��4NH3+6NO![]() 5N2+6H2O����ͬ�¶������£�n(NH3):n(NO)�����ʵ���֮�ȷֱ�Ϊ 4:1��3:1��1:3 ʱ���õ� NO �ѳ���������ͼ��ʾ��
5N2+6H2O����ͬ�¶������£�n(NH3):n(NO)�����ʵ���֮�ȷֱ�Ϊ 4:1��3:1��1:3 ʱ���õ� NO �ѳ���������ͼ��ʾ��

������ a �У�NO ����ʼŨ��Ϊ6��10-4mg��m-3���� A �㵽 B �㾭��0.8s����ʱ����� NO ���ѳ�����Ϊ_____mg��m-3��s-1��
������ b ��Ӧ NH3 �� NO �����ʵ���֮����_____��
(4)��ӵ绯ѧ���� NO����ԭ����ͼ��ʾ��д�������ĵ缫��Ӧʽ(��������Һ������)_____�����ճ��г�ȥ NO ��ԭ��_____(�����ӷ���ʽ��ʾ)��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪![]() ��
��![]() ��
��![]() ��
��![]() Ϊԭ��������������Ķ�����Ԫ�أ�
Ϊԭ��������������Ķ�����Ԫ�أ�![]() Ϊ�ؿ��к�����ߵĹ��ɽ���Ԫ�أ�
Ϊ�ؿ��к�����ߵĹ��ɽ���Ԫ�أ�![]() ��
��![]() ͬ���壬
ͬ���壬![]() ��
��![]() ͬ���ڣ���
ͬ���ڣ���![]() ��
��![]() ��ԭ������֮��Ϊ20���ס��ҷֱ�ΪԪ��E��A�ĵ��ʣ� ������ΪA��E�ֱ���B�γɵĶ�Ԫ���������ת����ϵ��ͼ��ʾ������˵������ȷ���ǣ� ��
��ԭ������֮��Ϊ20���ס��ҷֱ�ΪԪ��E��A�ĵ��ʣ� ������ΪA��E�ֱ���B�γɵĶ�Ԫ���������ת����ϵ��ͼ��ʾ������˵������ȷ���ǣ� ��
A.![]() ��
��![]() �γɵ�һ�ֻ��������Ư����
�γɵ�һ�ֻ��������Ư����
B.![]() ��
��![]() �γɵ����ӻ�������ܺ��зǼ��Լ�
�γɵ����ӻ�������ܺ��зǼ��Լ�
C.![]() �ĵ����������Ӧ�û���
�ĵ����������Ӧ�û���![]() �ĵ���
�ĵ���
D.��Ϊ��ɫ���壬��1mol������������Ӧת�Ƶ���3 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ�����ӵ�������ֵ�������£����й��� 1 L 0.1 mol/L FeCl3 ��Һ��˵������ȷ����
A.��Һ�к��е� Fe3+������ĿΪ 0.1NA
B.���� Cu �ۣ�ת�Ƶ�����ĿΪ 0.1NA
C.��ˮϡ�ͺ���Һ�� c(OH��) ��С
D.���� 0. 15 mol NaOH ��3c(Fe3+)+c(H+) = c(Na+) + c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��֤��������շֽ�IJ��ijͬѧ�������ִ������ֱ�����ˮ���չ�����pH��Cl-Ũ�ȡ�![]() ��������ı仯��ʵ��������ͼ��ʾ����������������ǣ� ��
��������ı仯��ʵ��������ͼ��ʾ����������������ǣ� ��
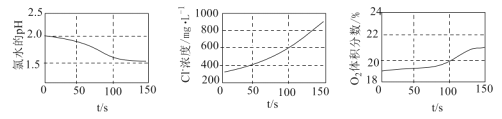
A.��0 s��150 s����ҺpH���͵�ԭ����![]() �ĵ���̶�����
�ĵ���̶�����
B.��0 s��150 s����Һ��![]() ���ӵ���ʼŨ�ȵ�
���ӵ���ʼŨ�ȵ�![]() ��
��
C.��50 s��150 s��![]() ��ƽ����������ԼΪ
��ƽ����������ԼΪ![]()
D.![]() ���շֽ�IJ�����
���շֽ�IJ�����![]() ��
��![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com