
【题目】C、N、S 的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1)CO2 的重整用 CO2 和 H2 为原料可得到 CH4 燃料。
已知: ①CH4 (g)+CO2(g)=2CO(g)+2H2(g) △H1=+247kJ/mol
②CH4 (g)+H2O(g)=CO(g)+3H2(g) △H2=+205kJ/mol
写出 CO2 重整的热化学方程式:_____。
(2) “亚碳酸盐法”吸收烟中的 SO2
①将烟气通入 1.0mol/L 的 Na2SO3 溶液,若此过程中溶液体积不变,则溶液的 pH 不断_____(填“减小”“不变” 或“增大)。当溶液 pH 约为 6 时,吸收 SO2 的能力显著下降,应更换吸收剂,此时溶液中 c(SO32-) =0.2mol/L, 则溶液中 c(HSO3-) =_____。
②室温条件下,将烟气通入(NH4)2SO3 溶液中,测得溶液 pH 与各组分物质的量分数的变化关系如图: b 点时溶液 pH=7,则 n(NH4+):n(HSO3—)= ______________ 。

(3)催化氧化法去除 NO。一定条件下,用 NH3 消除 NO 污染,其反应原理4NH3+6NO![]() 5N2+6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为 4:1、3:1、1:3 时,得到 NO 脱除率曲线如图所示:
5N2+6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为 4:1、3:1、1:3 时,得到 NO 脱除率曲线如图所示:

①曲线 a 中,NO 的起始浓度为6×10-4mg·m-3,从 A 点到 B 点经过0.8s,该时间段内 NO 的脱除速率为_____mg·m-3·s-1。
②曲线 b 对应 NH3 与 NO 的物质的量之比是_____。
(4)间接电化学法除 NO。其原理如图所示:写出阴极的电极反应式(阴极室溶液呈酸性)_____。吸收池中除去 NO 的原理_____(用离子方程式表示)。

【答案】CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H=163kJ/mo1 减小 1.6mol/L 3:1 1.5×104 3:1 ![]()
![]()
【解析】
(1)已知:①CH4 (g)+CO2(g)=2CO(g)+2H2(g) △H1=+247k/mol,
②CH4(g)+H2O(g)=CO(g)+3H2(g) △H2=+205k/mol,
根据盖斯定律,①-②×2得:CO2(g)+4H2(g)=CH4(g)+2H2O(g),据此计算△H;
(2)①二氧化硫通入亚硫酸钠溶液生成亚硫酸氢钠,亚硫酸氢钠显酸性,据此分析;根据反应方程式的量的关系计算可得;
②先判断溶质,写出电荷守恒式,在利用pH=7时,c(H+)=c(OH-)找出其他离子的等量关系,结合图示进行等量删减或替换,最后得出结果;
(3)①曲线a中,NO的起始浓度为6×10-4mgm-3,根据图象得到A、B处的NO脱除率,可得两处的NO的浓度,再计算脱除速率;
②NH3与NO的物质的量的比值越大,NO的脱除率越大,据此分析;
(4)阴极得到电子发生还原反应,结合酸性环境书写;阴极产物吸收NO。
(1)已知:①CH4(g)+CO2(g)=2CO(g)+2H2(g) △H1=+247k/mol,
②CH4(g)+H2O(g)=CO(g)+3H2(g) △H2=+205k/mol,
根据盖斯定律,由①②×2得反应:CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H=△H12△H2=163kJ/mo1,
故答案为:CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H=163kJ/mo1;
(2)①将烟气通入1.0mol/L的Na2SO3溶液,二氧化硫与亚硫酸钠和水反应生成亚硫酸氢钠,亚硫酸氢钠以电离为主,显酸性,故溶液pH不断减小;向亚硫酸钠溶液中通入二氧化硫生成亚硫酸氢钠,反应方程式SO2+Na2SO3+2H2O=2NaHSO3,溶液中反应的亚硫酸根离子和生成亚硫酸氢根离子的物质的量比为1:2,即溶液中参加反应的亚硫酸根为(1.00.2)mol/L,则生成c(![]() )=2×(1.00.2)mol/L=1.6mol/L,
)=2×(1.00.2)mol/L=1.6mol/L,
故答案为:减小;1.6mol/L;
②b点时溶液pH=7,此时溶液中的溶质是(NH4)2SO3和NH4HSO3,根据电荷守恒:c(![]() )+c(H+)=c(OH)+c(
)+c(H+)=c(OH)+c(![]() )+2c(
)+2c(![]() ),因pH=7,故c(H+)=c(OH),则c(
),因pH=7,故c(H+)=c(OH),则c(![]() )=c(
)=c(![]() )+2c(
)+2c(![]() ),由图可读出b点时,c(
),由图可读出b点时,c(![]() )=c(
)=c(![]() ),则c(
),则c(![]() )=3 c(
)=3 c(![]() ),因在同一体系,n(
),因在同一体系,n(![]() ):n(
):n(![]() )=3:1,
)=3:1,
故答案为:3:1;
(3)①曲线a中,NO的起始浓度为6×104mgm3,A点的脱除率为55%,B点的脱除率为75%,从A点到B点经过0.8s,该时间段内NO的脱除速率为6×104mgm3×(0.750.55)÷0.8s=1.5×104mgm3s1,
故答案为:1.5×104;
②NH3与NO的物质的量的比值越大,NO的脱除率越大,则物质的量之比分别为4:1,3:1,1:3时,对应的曲线为a,b,c,即曲线b对应的物质的量之比是3:1,
故答案为:3:1;
(4)阴极得到电子发生还原反应,根据图可知是![]() 在酸性条件下发生还原反应,生成
在酸性条件下发生还原反应,生成![]() ,其电极反应式为
,其电极反应式为![]() ;根据图示,吸收池中
;根据图示,吸收池中![]() 和NO是反应物,N2和
和NO是反应物,N2和![]() 是生成物,则吸收池中除去NO的原理是:
是生成物,则吸收池中除去NO的原理是:![]() ,
,
故答案为:![]() ;
;![]() 。
。


科目:高中化学 来源: 题型:
【题目】用纯净的 CaCO3 与 l00mL 稀盐酸反应制取 CO2,实验过程记录如图所示(CO2 的体积己折算为标准状况下的体积)。下列分析正确的是( )
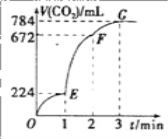
A.EF 段,用盐酸表示该反应的平均反应速率为 0.4 mol·(L·min) -1
B.OE 段表示的平均速率最快
C.F 点收集到的 CO2 的量最多
D.OE、EF、FG 三段中,该反应用二氧化碳表示的平均反应速率之比为 2∶6∶7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C变化如图所示。
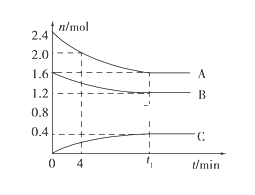
(1)写出该反应的化学方程式:___________;
(2)该温度下该反应的平衡常数为(保留两位有效数字)_______;
(3)已知:K(300℃)>K(350℃),该反应是________热反应;
(4)0~4分钟时,A的平均反应速率为____________;
(5)到达平衡时B的转化率为____________;
(6)恒容条件下,下列措施中能使![]() 降低的有__________。
降低的有__________。
A 充入氦气 B 使用催化剂
C 再充入2.4mol A和1.6mol B D 降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】枸橼酸( )是一种弱有机酸,是柑橘类水果中产生的一种天然防腐剂,也是食物和饮料中的酸味添加剂。
)是一种弱有机酸,是柑橘类水果中产生的一种天然防腐剂,也是食物和饮料中的酸味添加剂。
(1)枸橼酸属于____(填“无机化合物”或“有机化合物”)。
(2)枸橼酸中含氧官能团有羧基和____(填名称)。
(3)向枸橼酸溶液中滴入2~3滴紫色石蕊试液,溶液颜色变红,说明枸橼酸溶液具有____性。
(4)1 mol枸橼酸最多消耗____mol NaOH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A原子和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在加热下与足量的B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物。试根据以上叙述回答:
(1)元素名称:A_____,B______,C_______。
(2)D元素位于周期表中第_____周期_____族,它的最高价氧化物对应的水化物的化学式是_____________________。
(3)写出AB2与C2B2反应的化学方程式:____________。
(4)写出A单质与D元素的最高价氧化物对应水化物的浓溶液共热反应的化学方程式:___。若要设计实验验证该反应产物,则验证的产物顺序是_______(填写产物的化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有K2Cr2O7的废水具有较强的毒性,工业上常用钡盐沉淀法处理含有 K2Cr2O7 的废水并回收重铬酸,具体的流程如下:
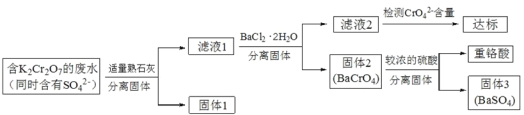
已知:CaCr2O7、BaCr2 O7 易溶于水,其它几种盐在常温下的溶度积如下表所示。
物质 | CaSO4 | CaCrO4 | BaCrO4 | BaSO4 |
溶度积 | 9.1106 | 2.30 102 | 1.17 1010 | 1.08 1010 |
(1)用离子方程式表示K2Cr2O7溶液中同时存在 K2CrO4的原因(将离子方程式补充完整):______Cr2O72-+______![]() ____CrO42+______
____CrO42+______
(2)向滤液 1 中加入 BaCl2 ![]() 2H2O 的目的是使 CrO42- 从溶液中沉淀出来。
2H2O 的目的是使 CrO42- 从溶液中沉淀出来。
①结合上述流程说明熟石灰的作用:_____。
②结合表中数据,说明选用Ba2 不选用Ca2处理废水的理由:_____。
③ 研究温度对CrO42 沉淀效率的影响。实验结果如下:在相同的时间间隔内,不同温度下CrO42- 的沉淀率(沉淀率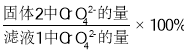 如图所示)
如图所示)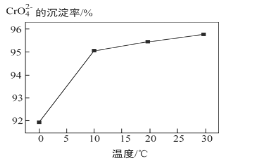
已知:![]()
CrO42- 的沉淀效率随温度变化的原因是_____。
(3)向固体2中加入硫酸,回收重铬酸。
①硫酸浓度对重铬酸的回收率如下图(左)所示。结合化学平衡移动原理,解释使用 0.450 mol/L 的硫酸时,重铬酸的回收率明显高于使用 0.225 mol/L 的硫酸的原因:_____。
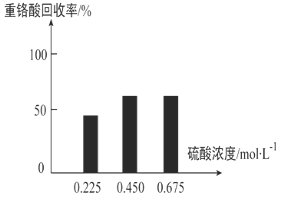
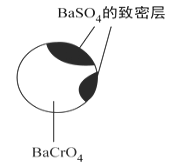
②回收重铬酸的原理如上图(右)所示。当硫酸浓度高于0.450 mol/L时,重铬酸的回收率没有明显变化,其原因是_____。
(4)综上所述,沉淀BaCrO4进一步回收重铬酸的效果与_____、_____、有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研团队研究将磷钨酸(H3PW12O40,以下简称HPW)代替浓硫酸作为酯化反应的催化剂,但HPW自身存在比表面积小、易溶于有机溶剂而难以重复使用等缺点,将其负载在多孔载体(如硅藻土、C等)上则能有效克服以上不足,提高其催化活性。用HPW负载在硅藻土上催化制取乙酸正丁酯的酯化率与HPW负载量的关系(温度:120℃,时间:2h)如图所示,下列说法不正确的是
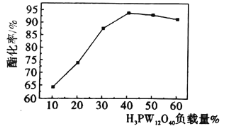
A.与HPW相比,HPW/硅藻土比表面积显著增加,有助于提高其催化性能
B.当HPW负载量为40%时达到饱和,酯化率最高
C.用HPW/硅藻土代替传统催化剂,可减少设备腐蚀等不足
D.不同催化剂对酯化率的影响程度主要取决于化学反应正向进行的程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,硫酸盐 MSO4(M2+代表 Ba2+、Sr2+)的沉淀溶解平衡曲线如图所示。已知:p ( M2+ ) =-lgc ( M2+ ),p(SO42-)=-lgc(SO42-)。向 10mL 0.01 mol/L Na2SO4 溶液中滴入 1 滴(约 0. 05 mL) 0. 01 mol/L BaCl2 溶液岀现白色浑浊,而滴入 1 滴(约 0. 05 mL) 0. 01 mol/L SrCl2 溶液无浑浊出现。下列说法中错误的是
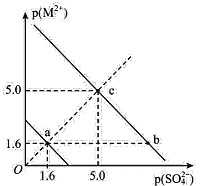
A.该温度下,溶度积常数 Ksp(BaSO4)<Ksp( SrSO4)
B.欲使c点对应BaSO4溶液移向b点,可加浓BaCl2溶液
C.欲使c点对应SrSO4溶液移向a点,可加浓SrCl2溶液
D.SrSO4(s)+Ba2+(aq)BaSO4(s)+Sr2+(aq)的平衡常数为106.8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是地壳中含量最高的金属元素,其单质及其化合物在生产生活中的应用十分广泛。
(1)铝原子最外层电子排布式是________,铝原子核外有___种能量不同的电子。
(2)1827年,德国化学家维勒用金属钾与无水氯化铝反应而制得了金属铝。不用钾与氯化铝溶液制铝的理由是_________;现代工业炼铝是以Al2O3为原料,与冰晶石(Na3A1F6)在熔融状态下进行电解,其阴极电极反应式为___________________________。
(3)用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如:2Al+4BaO![]() 3Ba↑+BaO·Al2O3,用化学平衡移动原理解释上述方法可制取金属Ba的原因是________。
3Ba↑+BaO·Al2O3,用化学平衡移动原理解释上述方法可制取金属Ba的原因是________。
(4)LiAlH4由Li+、A1H4-构成,是有机合成中常用的试剂,LiAlH4在125℃分解为LiH、H2和Al。
①比较Li+、 H-、Al3+、H+离子半径大小____________。
②写出LiAlH4分解的方程式(需配平)_______,若反应生成3.36 L氢气(标准状况下),则有____g铝生成。
③LiAlH4与乙醛反应可生成乙醇,推断LiAlH4是反应的_________剂。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com