
【题目】一定温度下,硫酸盐 MSO4(M2+代表 Ba2+、Sr2+)的沉淀溶解平衡曲线如图所示。已知:p ( M2+ ) =-lgc ( M2+ ),p(SO42-)=-lgc(SO42-)。向 10mL 0.01 mol/L Na2SO4 溶液中滴入 1 滴(约 0. 05 mL) 0. 01 mol/L BaCl2 溶液岀现白色浑浊,而滴入 1 滴(约 0. 05 mL) 0. 01 mol/L SrCl2 溶液无浑浊出现。下列说法中错误的是
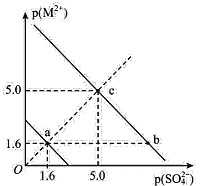
A.该温度下,溶度积常数 Ksp(BaSO4)<Ksp( SrSO4)
B.欲使c点对应BaSO4溶液移向b点,可加浓BaCl2溶液
C.欲使c点对应SrSO4溶液移向a点,可加浓SrCl2溶液
D.SrSO4(s)+Ba2+(aq)BaSO4(s)+Sr2+(aq)的平衡常数为106.8
【答案】C
【解析】
由题意可知Ksp( BaSO4)=c(Ba2+)·c(SO![]() )<
)<![]()
![]() ,Ksp( SrSO4)=c(Sr2+)·c(SO
,Ksp( SrSO4)=c(Sr2+)·c(SO![]() )>
)>![]()
![]() ,可判断a 点所在直线(实线)表示SrSO4沉淀溶解平衡曲线,b、c点所在直线表示BaSO4沉淀溶解平衡曲线。
,可判断a 点所在直线(实线)表示SrSO4沉淀溶解平衡曲线,b、c点所在直线表示BaSO4沉淀溶解平衡曲线。
A.利用数据可得Ksp(BaSO4)=c(Ba2+)·c(SO![]() )=1.0×10-5×1.0×10-5=1×10-10,Ksp(SrSO4)= c(Sr2+)·c(SO
)=1.0×10-5×1.0×10-5=1×10-10,Ksp(SrSO4)= c(Sr2+)·c(SO![]() )=1.0×10-1.6×1.0×10-1.6=1×10-10=1×
)=1.0×10-1.6×1.0×10-1.6=1×10-10=1×![]() ,故A正确;
,故A正确;
B.欲使c点BaSO4饱和溶液(Ba2+、SO![]() 浓度相等)移向b点(饱和溶液),需使c(Ba2+)增大、c(SO
浓度相等)移向b点(饱和溶液),需使c(Ba2+)增大、c(SO![]() )减小,则可加入BaCl2浓溶液,故B正确;
)减小,则可加入BaCl2浓溶液,故B正确;
C.欲使c点SrSO4溶液(不饱和溶液)移向a点(饱和溶液),需使c(Sr2+)、c(SO![]() )都增大且保持相等,则需加入SrSO4固体,故C错误;
)都增大且保持相等,则需加入SrSO4固体,故C错误;
D.SrSO4(s) +Ba2+(aq)![]() BaSO4(s) +Sr2+(aq)的平衡常数K=
BaSO4(s) +Sr2+(aq)的平衡常数K=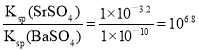 ,故D正确;
,故D正确;
答案选C。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】2-氨基-3-氯苯甲酸(F)是重要的医药中间体,其制备流程图如下:
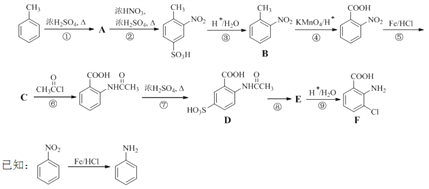
回答下列问题:
(1)![]() 分子中不同化学环境的氢原子共有_______种,共面原子数目最多为_______。
分子中不同化学环境的氢原子共有_______种,共面原子数目最多为_______。
(2)B的名称为_________。写出符合下列条件B的所有同分异构体的结构简式_______。
a.苯环上只有两个取代基且互为邻位 b.既能发生银镜反应又能发生水解反应
(3)该流程未采用甲苯直接硝化的方法制备B,而是经由①②③三步反应制取B,其目的是______________。
(4)写出⑥的化学反应方程式:_________,该步反应的主要目的是____________。
(5)写出⑧的反应试剂和条件:_______________;F中含氧官能团的名称为__________。
(6)在方框中写出以 为主要原料,经最少步骤制备含肽键聚合物的流程。__________
为主要原料,经最少步骤制备含肽键聚合物的流程。__________
 ……
……![]() 目标化合物
目标化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N、S 的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1)CO2 的重整用 CO2 和 H2 为原料可得到 CH4 燃料。
已知: ①CH4 (g)+CO2(g)=2CO(g)+2H2(g) △H1=+247kJ/mol
②CH4 (g)+H2O(g)=CO(g)+3H2(g) △H2=+205kJ/mol
写出 CO2 重整的热化学方程式:_____。
(2) “亚碳酸盐法”吸收烟中的 SO2
①将烟气通入 1.0mol/L 的 Na2SO3 溶液,若此过程中溶液体积不变,则溶液的 pH 不断_____(填“减小”“不变” 或“增大)。当溶液 pH 约为 6 时,吸收 SO2 的能力显著下降,应更换吸收剂,此时溶液中 c(SO32-) =0.2mol/L, 则溶液中 c(HSO3-) =_____。
②室温条件下,将烟气通入(NH4)2SO3 溶液中,测得溶液 pH 与各组分物质的量分数的变化关系如图: b 点时溶液 pH=7,则 n(NH4+):n(HSO3—)= ______________ 。

(3)催化氧化法去除 NO。一定条件下,用 NH3 消除 NO 污染,其反应原理4NH3+6NO![]() 5N2+6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为 4:1、3:1、1:3 时,得到 NO 脱除率曲线如图所示:
5N2+6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为 4:1、3:1、1:3 时,得到 NO 脱除率曲线如图所示:

①曲线 a 中,NO 的起始浓度为6×10-4mg·m-3,从 A 点到 B 点经过0.8s,该时间段内 NO 的脱除速率为_____mg·m-3·s-1。
②曲线 b 对应 NH3 与 NO 的物质的量之比是_____。
(4)间接电化学法除 NO。其原理如图所示:写出阴极的电极反应式(阴极室溶液呈酸性)_____。吸收池中除去 NO 的原理_____(用离子方程式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是分离混合物时常用的仪器,可以进行的混合物分离操作分别是()
![]()
A.蒸馏、过滤、萃取、蒸发B.蒸馏、蒸发、萃取、过滤
C.萃取、过滤、蒸馏、蒸发D.过滤、蒸发、萃取、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。室温下,下列关于 1 L 0.1 mol/L FeCl3 溶液的说法中正确的是
A.溶液中含有的 Fe3+离子数目为 0.1NA
B.加入 Cu 粉,转移电子数目为 0.1NA
C.加水稀释后,溶液中 c(OH-) 减小
D.加入 0. 15 mol NaOH 后,3c(Fe3+)+c(H+) = c(Na+) + c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是一种高效清洁的火箭燃料,0.5 mol气态肼完全燃烧生成氮气和水蒸气时,放出267 kJ的热量,下列热化学方程式书写正确的是( )
A.N2H4(g)+O2(g)= N2(g)+2H2O(g) ΔH=+534 kJ/mol
B.![]() N2H4(g)+
N2H4(g)+![]() O2(g)=
O2(g)=![]() N2(g)+H2O(g) ΔH=-267 kJ/mol
N2(g)+H2O(g) ΔH=-267 kJ/mol
C.N2H4(g)+O2(g)= N2(g)+2H2O(g) ΔH=-534 kJ/mol
D.N2H4(g)+O2(g)= N2(g)+2H2O(l) ΔH=-534 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
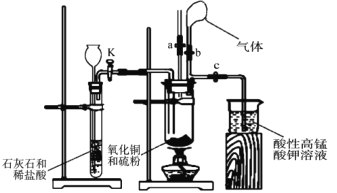
【题目】为探究氧化铜与硫的反应并分析反应后的固体产物,设计如下实验装置。
(1)如图连接实验装置,并_____。
(2)将氧化铜粉末与硫粉按 5:1 质量比混合均匀。
(3)取适量氧化铜与硫粉的混合物装入大试管中,固定在铁架台上,打开_____ 和止水夹 a 并______,向长颈漏斗中加入稀盐酸,一段时间后,将燃着的木条放在止水夹 a 的上端导管口处,观察到木条熄灭,关闭活塞 K 和止水夹 a,打开止水夹 b。该实验步骤的作用是______,石灰石与稀盐酸反应的离子方程式为___________________。
(4)点燃酒精灯,预热大试管,然后对准大试管底部集中加热,一段时间后,气球膨胀, 移除酒精灯,反应继续进行。待反应结束,发现气球没有变小,打开止水夹 c,观察到酸性高锰酸钾溶液褪色后,立即用盛有氢氧化钠溶液的烧杯替换盛装酸性高锰酸钾溶液的烧杯,并打开活塞 K。这样操作的目的是__________________。
(5)拆下装置,发现黑色粉末混有砖红色粉末。取少量固体产物投入足量氨水中,得到无色溶液、但仍有红黑色固体未溶解,且该无色溶液在空气中逐渐变为蓝色。查阅资料得知溶液颜色变化是因为发生了以下反应:4[Cu(NH3)2]+ + O2+8NH3 H2O=4[Cu(NH3)4]2++4OH-+6H2O。
①经分析,固体产物中含有Cu2O。Cu2O 溶于氨水反应的离子方程式为______。
②仍有红色固体未溶解,表明氧化铜与硫除发生反应 4CuO + S![]() 2Cu2O+SO2外,还一定发生了其他反应,其化学方程式为_________。
2Cu2O+SO2外,还一定发生了其他反应,其化学方程式为_________。
③进一步分析发现 CuO 已完全反应,不溶于氨水的黑色固体可能是_____(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水电池是我国1991年研制的以铝—空气—海水为能源的新型电池,可用于航海标志灯的供电。
(1)下列装置的模型,能体现海水电池工作原理的是_______(填字母)。
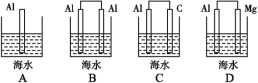
(2)海水电池工作过程中,负极的电极反应式为____,该极是电子___(填“流出”或“流入”)的一极,发生___反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是制备重铬酸钾的实验装置示意图:
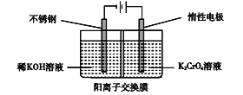
下列说法不正确的是
A.在阴极室,发生的电极反应为: 2H2O+2e- = 2OH -+ H2↑
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O向右移动
Cr2O72-(橙色)+H2O向右移动
C.该制备过程总反应为: 4K2CrO4 + 4H2O![]() 2K2Cr2O7 + 4KOH + 2H2↑+ O2↑
2K2Cr2O7 + 4KOH + 2H2↑+ O2↑
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比(nK/nCr)为d,则此时铬酸钾的转化率为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com