
【题目】如图是制备重铬酸钾的实验装置示意图:
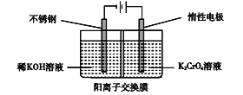
下列说法不正确的是
A.在阴极室,发生的电极反应为: 2H2O+2e- = 2OH -+ H2↑
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O向右移动
Cr2O72-(橙色)+H2O向右移动
C.该制备过程总反应为: 4K2CrO4 + 4H2O![]() 2K2Cr2O7 + 4KOH + 2H2↑+ O2↑
2K2Cr2O7 + 4KOH + 2H2↑+ O2↑
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比(nK/nCr)为d,则此时铬酸钾的转化率为![]()
【答案】D
【解析】
A. 电极均为惰性电极,在阴极室发生还原反应,水得电子变成氢气,电极反应为:2H2O+2e- = 2OH -+ H2↑,故A正确;
B. 阳极室发生氧化反应,水失去电子放电,电极反应为:2H2O-4e-=4H++O2↑,阳极区氢离子浓度增大,平衡右移,溶液逐渐由黄色变为橙色,故B正确;
C. 阴极电极反应为:4H2O+4e-=4OH-+2H2↑,阳极反应为:2H2O-4e-=4H++O2↑,4CrO42-+4H+═2Cr2O72-+2H2O,故总制备方程式为4K2CrO4 +4H2O![]() 2K2Cr2O7 +4KOH+2H2↑+O2↑,故C正确;
2K2Cr2O7 +4KOH+2H2↑+O2↑,故C正确;
D. 设加入反应容器内的K2CrO4为1mol,反应过程中有xmol K2CrO4转化为K2Cr2O7,则阳极区剩余K2CrO4为(1-x)mol,对应的n(K)=2(1-x)mol,n(Cr)=(1-x)mol,生成的K2Cr2O7为![]() mol,对应的n(K)=xmol,n(Cr)=xmol,根据:K与Cr的物质的量之比为d,
mol,对应的n(K)=xmol,n(Cr)=xmol,根据:K与Cr的物质的量之比为d,![]() =d,解得x=2-d,转化率为
=d,解得x=2-d,转化率为![]() ×100%=2-d,故D错误;
×100%=2-d,故D错误;
故选:D。


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,硫酸盐 MSO4(M2+代表 Ba2+、Sr2+)的沉淀溶解平衡曲线如图所示。已知:p ( M2+ ) =-lgc ( M2+ ),p(SO42-)=-lgc(SO42-)。向 10mL 0.01 mol/L Na2SO4 溶液中滴入 1 滴(约 0. 05 mL) 0. 01 mol/L BaCl2 溶液岀现白色浑浊,而滴入 1 滴(约 0. 05 mL) 0. 01 mol/L SrCl2 溶液无浑浊出现。下列说法中错误的是
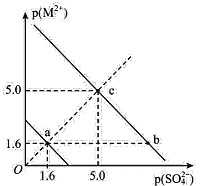
A.该温度下,溶度积常数 Ksp(BaSO4)<Ksp( SrSO4)
B.欲使c点对应BaSO4溶液移向b点,可加浓BaCl2溶液
C.欲使c点对应SrSO4溶液移向a点,可加浓SrCl2溶液
D.SrSO4(s)+Ba2+(aq)BaSO4(s)+Sr2+(aq)的平衡常数为106.8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是地壳中含量最高的金属元素,其单质及其化合物在生产生活中的应用十分广泛。
(1)铝原子最外层电子排布式是________,铝原子核外有___种能量不同的电子。
(2)1827年,德国化学家维勒用金属钾与无水氯化铝反应而制得了金属铝。不用钾与氯化铝溶液制铝的理由是_________;现代工业炼铝是以Al2O3为原料,与冰晶石(Na3A1F6)在熔融状态下进行电解,其阴极电极反应式为___________________________。
(3)用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如:2Al+4BaO![]() 3Ba↑+BaO·Al2O3,用化学平衡移动原理解释上述方法可制取金属Ba的原因是________。
3Ba↑+BaO·Al2O3,用化学平衡移动原理解释上述方法可制取金属Ba的原因是________。
(4)LiAlH4由Li+、A1H4-构成,是有机合成中常用的试剂,LiAlH4在125℃分解为LiH、H2和Al。
①比较Li+、 H-、Al3+、H+离子半径大小____________。
②写出LiAlH4分解的方程式(需配平)_______,若反应生成3.36 L氢气(标准状况下),则有____g铝生成。
③LiAlH4与乙醛反应可生成乙醇,推断LiAlH4是反应的_________剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO![]() 2CO2+N2(降温后该反应的平衡常数变大)为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2(降温后该反应的平衡常数变大)为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)(mol/L) | 1.00×10﹣3 | 4.50×10﹣4 | 2.50×10﹣4 | 1.50×10﹣4 | 1.00×10﹣4 | 1.00×10﹣4 |
c(CO)(mol/L) | 3.60×10﹣3 | 3.05×10﹣3 | 2.85×10﹣3 | 2.75×10﹣3 | 2.70×10﹣3 | 2.70×10﹣3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)反应的Q___0(填写“>”、“<”、“=”)。
(2)前2s内的平均反应速率v(N2)=___。
(3)计算在该温度下,反应的平衡常数K=___。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是___。
A.选用更有效的催化剂
B.升高反应体系的温度
C.降低反应体系的温度
D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
实验 编号 | T(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
Ⅱ | ___ | ___ | ___ | 124 |
Ⅲ | 350 | ___ | ___ | 124 |
①请在上表空格中填入剩余的实验条件数据。
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水硫酸铜在加热条件下能发生分解反应,生成氧化铜、二氧化硫、三氧化硫和氧气。某学生试图用如图所示装置来确定该化学反应中各物质的计量关系。
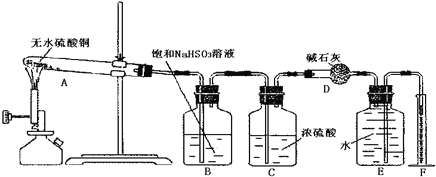
试回答:
(1)加热过程中,试管A中发生的实验现象可能有___。
(2)装置E和F的作用是___;
(3)该学生使用装置B的本意是除去混合气体中的三氧化硫以提纯氧气,他的做法正确吗?为什么?___。
(4)另一学生将9.6g无水硫酸铜充分加热使其完全分解后,用正确的实验方法除去了生成物中的二氧化硫和三氧化硫,最后测出氧气的体积为448mL(标准状况)。据此可计算出二氧化硫为___mol,三氧化硫为___mol。
(5)由上述实验数据可知无水硫酸铜受热分解的化学方程式:___。
(6)上述装置可以简化而不影响实验效果。请你提出一个简化方案,达到使装置最简单而不影响实验效果的目的:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”是生活中常用的消毒剂,可与硫酸溶液反应制取氯气,反应原理为NaClO+NaCl+H2SO4![]() Na2SO4+Cl2↑+H2O。为探究氯气的性质,某同学利用此原理制氯气并设计了如下所示的实验装置:
Na2SO4+Cl2↑+H2O。为探究氯气的性质,某同学利用此原理制氯气并设计了如下所示的实验装置:
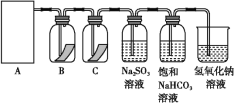
(1)从①、②、③装置中选择合适的制氯气装置(A处)______(填写序号)。
(2)装置B、C中依次放的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是________________;说明该装置存在明显的缺陷,请提出合理的改进方法:________________。
(3)为了验证氯气的氧化性,将氯气通入Na2SO3溶液中,反应的离子方程式为_____,然后检验反应后溶液中是否含有S![]() 。检验S
。检验S![]() 的方法是:取少量反应后的溶液于试管中,先加入足量的________________至无明显现象,然后再加入少量____溶液,有白色沉淀生成,说明含有S
的方法是:取少量反应后的溶液于试管中,先加入足量的________________至无明显现象,然后再加入少量____溶液,有白色沉淀生成,说明含有S![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬是一种氧气吸收剂, 通常以二水盐[Cr(CH3COO)2]2 ·2H2O(式量:376)的形式存在,难溶于冷水,易溶于盐酸。其制备原理和实验装置:
制备原理:![]()
实验装置:(如图所示)
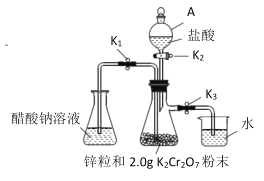
(1)仪器 A 的名称是__________。
(2)装好试剂后按上述装置进行实验,完成下表内容。
操作步骤 | 实验现象 | 发生反应的离子方程式 |
关闭①___________________,打开②_______________,(用K1、K2、K3填写,下同)使盐酸缓慢加入至抽滤瓶中 | 抽滤瓶中锌粒溶解,溶液由橙色逐渐变成蓝色,有少量气泡 | ③________,Zn+2H+=Zn2++H2↑ |
抽滤瓶中产生大量气体时快速加入适量盐酸,关闭K2和④__________________,打开⑤_________ | 抽滤瓶中⑥____________ | Zn+2H+=Zn2++H2↑ |
当溶液完全转移后,迅速塞紧锥形瓶,用冷水冷却 | 锥形瓶中有深红色晶体析出 | ⑦_____________ |
(3)洗涤产品后干燥、称量,得到 1.0g 固体。列式表示产率:____(不必计算出结果,K2Cr2O7 式量:294)。在实验中如果盐酸过量,会导致产率偏________。(填“高”或“低”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①25℃时,NaHCO3溶液呈碱性,原因是___________水解引起的(填“Na+”或“HCO3-”);
②常温下,0.0100mol/L 盐酸的pH=___________;
③用0.0100mol/L 盐酸滴定未知浓度的NaOH溶液,酚酞作指示剂,滴定终点时,溶液的颜色由浅红色变为___________(填“蓝色”或“无色”),且半分钟内保持不变。
(2)①已知H2与O2反应生成1mol H2O(g)时放出241.8kJ 的热量,请完成该反应的热化学方程式:2H2(g) +O2(g)=2H2O(g) △H=___________kJ/mol;
②已知:C(石墨,s)=C(金刚石,s) △H>0,则稳定性: 石墨___________金刚石 (填“>”、“<”或“=”)。
(3)在某密闭容器中进行可逆反应:FeO(s)+CO(g)![]() Fe(s)+CO2(g) △H>0,平衡常数表达式为K=
Fe(s)+CO2(g) △H>0,平衡常数表达式为K=![]() 。
。
①反应达到平衡后,向容器中通入CO,化学平衡向__________方向移动(填“正反应”或“逆反应”);
②若升高温度,平衡常数K___________(填“增大”、“减少”或“不变”);
③查阅资料得知1100℃时K=0.263。某时刻测得容器中c(CO2)=0.025 mol/L,c(CO)=0.10 mol/L,此时刻反应__________平衡状态(填“达到”或“未达到”)。
(4)电化学是研究化学能与电能相互转化的装置、过程和效率的科学。
①根据氧化还原反应:2Ag+(aq)+Cu(s)=2Ag(s)+Cu2+(aq),设计的原电池如图一所示,X溶液时__________溶液(填“CuSO4”或“AgNO3”);
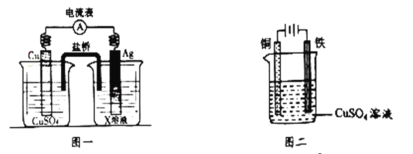
②图二装置在铁件上镀铜,铁作阴极,则铜极上的电极反应是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、N及S的化合物用途非常广泛。回答下列问题;
(1)基态Fe原子价电子排布图为____;基态S原子的核外电子占据最高能级的电子云轮廓图为__________形。
(2)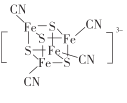 团簇离子中,Fe2+、Fe3+数目之比为______;与铁形成配位键的原子是________,铁的配位数为_________。
团簇离子中,Fe2+、Fe3+数目之比为______;与铁形成配位键的原子是________,铁的配位数为_________。
(3)四氟铵可通过下列反应制备:NF3+F2 + BF3 =NF4 BF4
①NF3的空间构型为_____ , 中心原子的杂化方式是______。
②NF4BF4存在的作用力有________(填字母)。
A. σ键 B. π键 C.离子键. D.配位键
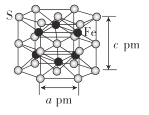
(4)Fe与S形成的一种化合物晶体的结构如图所示,六棱柱底边边长为a pm,高为c pm,阿伏加德罗常数的值为NA,该Fe、S化合物晶体的密度为_____(列出计算式)g. cm-3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com