
【题目】超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO![]() 2CO2+N2(降温后该反应的平衡常数变大)为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2(降温后该反应的平衡常数变大)为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)(mol/L) | 1.00×10﹣3 | 4.50×10﹣4 | 2.50×10﹣4 | 1.50×10﹣4 | 1.00×10﹣4 | 1.00×10﹣4 |
c(CO)(mol/L) | 3.60×10﹣3 | 3.05×10﹣3 | 2.85×10﹣3 | 2.75×10﹣3 | 2.70×10﹣3 | 2.70×10﹣3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)反应的Q___0(填写“>”、“<”、“=”)。
(2)前2s内的平均反应速率v(N2)=___。
(3)计算在该温度下,反应的平衡常数K=___。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是___。
A.选用更有效的催化剂
B.升高反应体系的温度
C.降低反应体系的温度
D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
实验 编号 | T(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
Ⅱ | ___ | ___ | ___ | 124 |
Ⅲ | 350 | ___ | ___ | 124 |
①请在上表空格中填入剩余的实验条件数据。
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号___。
【答案】> 1.88×10-4molL-1s-1 5000 C、D 280 1.20×10-3 5.80×10-3 1.20×10-3 5.80×10-3 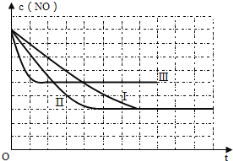
【解析】
(1)结合平衡随温度变化情况分析;
(2)根据v=![]() 计算平均反应速率v(NO),再计算v(N2);
计算平均反应速率v(NO),再计算v(N2);
(3)反应2NO+2CO![]() 2CO2+N2的反应的平衡常数表达式K=
2CO2+N2的反应的平衡常数表达式K=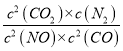 ,再结合平衡时各物质的浓度计算平常常数;
,再结合平衡时各物质的浓度计算平常常数;
(4)结合影响平衡移动的因素分析;
(5)①目的是研究温度和催化剂的比表面积对反应速率的影响,所以在实验时应保持NO、CO的初始浓度不变,让温度、比表面积其中一个量变化,Ⅰ、Ⅱ研究的是催化剂的比表面积对速率的影响,因此可确定Ⅱ中温度为280℃;
②Ⅰ、Ⅱ研究的是催化剂的比表面积对速率的影响,因此可确定Ⅱ中温度为280℃;Ⅱ、Ⅲ的催化剂比表面积相同,研究的是温度对速率的影响;Ⅰ、Ⅲ催化剂的比表面积不同,温度不同,研究温度、催化剂的比表面积对反应速率的影响;绘图时,要注意达平衡的时间、平衡浓度的相对大小:Ⅱ与Ⅰ温度相同,平衡不移动,平衡浓度相同,但Ⅱ催化剂比表面积增大,达平衡时间短;Ⅲ与Ⅱ的催化剂比表面积相同,Ⅲ温度高,温度升高,不仅达平衡时间缩短,平衡向左移动,使NO的平衡浓度也增大。
(1)其反应2NO+2CO![]() 2CO2+N2平衡后降温,该反应的平衡常数变大,说明降温平衡正向移动,即正反应放热,即反应的Q>0;
2CO2+N2平衡后降温,该反应的平衡常数变大,说明降温平衡正向移动,即正反应放热,即反应的Q>0;
(2)前2s内的平均反应速率v(NO)=![]() =0.375×10-4mol/(L·s),则v(N2)=
=0.375×10-4mol/(L·s),则v(N2)=![]() ×0.375×10-4mol/(L·s)≈1.88×10-4molL-1s-1;
×0.375×10-4mol/(L·s)≈1.88×10-4molL-1s-1;
(3)反应2NO+2CO![]() 2CO2+N2的反应的平衡常数表达式K=
2CO2+N2的反应的平衡常数表达式K=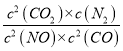 ,4s后反应达到平衡,此时平衡浓度c(NO)= 1.00×10-4molL-1、c(CO)= 2.70×10-3molL-1、c(CO2)=9.0×10-4molL-1、c(N2)= 4.5×10-4molL-1,则在该温度下,反应的平衡常数K=
,4s后反应达到平衡,此时平衡浓度c(NO)= 1.00×10-4molL-1、c(CO)= 2.70×10-3molL-1、c(CO2)=9.0×10-4molL-1、c(N2)= 4.5×10-4molL-1,则在该温度下,反应的平衡常数K=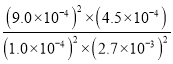 =5000;
=5000;
(4)A.选用更有效的催化剂,可改变反应速率,但不改变平衡的移动,对NO的转化率无影响,故A错误;
B.升高反应体系的温度,平衡逆向移动,降低NO的转化率,故B错误;
C.降低反应体系的温度,平衡正向移动,提高NO的转化率,故C正确;
D.缩小容器的体积,压强增大,平衡正向移动,提高NO的转化率,故D正确;
故答案为CD;
(5)①目的是研究温度和催化剂的比表面积对反应速率的影响,所以在实验时应保持NO、CO的初始浓度不变,让温度、比表面积其中一个量变化,Ⅰ、Ⅱ研究的是催化剂的比表面积对速率的影响,因此可确定Ⅱ中温度为280℃,故上表空格中填入剩余的实验条件数据为:Ⅱ、280;1.20×10-3;5.80×10-3;Ⅲ、1.20×10-3;5.80×10-3;
②Ⅰ、Ⅱ研究的是催化剂的比表面积对速率的影响;Ⅱ、Ⅲ的催化剂比表面积相同,研究的是温度对速率的影响;Ⅰ、Ⅲ催化剂的比表面积不同,温度不同,研究温度、催化剂的比表面积对反应速率的影响;绘图时,要注意达平衡的时间、平衡浓度的相对大小:Ⅱ与Ⅰ温度相同,平衡不移动,平衡浓度相同,但Ⅱ催化剂比表面积增大,达平衡时间短;Ⅲ与Ⅱ的催化剂比表面积相同,Ⅲ温度高,温度升高,不仅达平衡时间缩短,平衡向左移动,使NO的平衡浓度也增大,三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图为: 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下图是分离混合物时常用的仪器,可以进行的混合物分离操作分别是()
![]()
A.蒸馏、过滤、萃取、蒸发B.蒸馏、蒸发、萃取、过滤
C.萃取、过滤、蒸馏、蒸发D.过滤、蒸发、萃取、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水电池是我国1991年研制的以铝—空气—海水为能源的新型电池,可用于航海标志灯的供电。
(1)下列装置的模型,能体现海水电池工作原理的是_______(填字母)。
(2)海水电池工作过程中,负极的电极反应式为____,该极是电子___(填“流出”或“流入”)的一极,发生___反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠有多种化合物,如氧化钠、过氧化钠、氢氧化钠、碳酸钠、碳酸氢钠等等,这些物质在实际生活中有广泛的应用,一定条件下相互间能进行转化。
完成下列计算:
(1)将7.8克Na2O2完全溶解于93.8克水中,所得溶液的质量百分比浓度为______。
(2)将11.6克二氧化碳和水蒸汽的混合物与足量的Na2O2充分反应,固体质量增加了3.6克,则原混合气体的平均分子量为______。
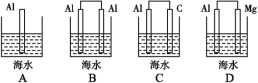
(3)向100 mL NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M(不含结晶水)。通入二氧化碳的体积V(标准状况下)与M的质量W的关系如下图所示。
①推断b点时M的组成成份(写出计算过程)____________。
②若向b点的盐溶液中只加入0.03mol某钠的化合物,充分反应后,减压低温蒸发得到无水Na2CO3 8.48g,则加入的物质可以是________或_______。
(4)由31g NaOH和NaHCO3的固体混合物,在密闭密器中加热到250℃,经充分反应后排出气体、冷却,称得剩余固体的质量为N g,试分析不同N值时,剩余固体的组成成份(已知NaHCO3的分解温度低于250℃)。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子聚合物P的合成路线如图:

(1)写出反应所需试剂与条件。反应①___;反应⑦___。
(2)写出反应类型:反应③___;反应⑥___。
(3)写出结构简式.E___;P___。
(4)设计反应⑥⑦的目的是___。
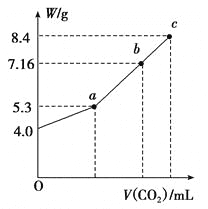
(5)写出用1,3-丁二烯与乙酸为原料合成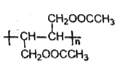 的合成路线(无机原料任选)___。
的合成路线(无机原料任选)___。
(合成路线的常用表示方法为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲用浓硝酸法(测定反应后生成气体的量)测定某铜银合金中铜的质量分数,但资料表明:反应中除了生成NO2气体外还会有少量的NO生成;常温下NO2和N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在。为完成测定并验证确有NO生成,有人设计如下实验:
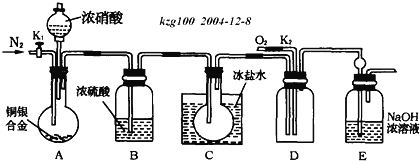
(1)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是___。
(2)装置B瓶的作用是___。
(3)A中的反应停止后,打开D中的活塞K2,并通入氧气,若反应确有NO产生,则D中应出现的现象是___;实验发现,通入氧气温度的高低对实验现象有较大影响,则为便于观察应通入___(填“冷”或“热”)的氧气。
(4)为减小测量误差,在A中反应完成和D中出现现象后,还应继续进行的操作是___。
(5)实验测得下列数据:所用铜银合金质量:15.0g、浓硝酸:40mL13.5mol/L;实验后A中溶液体积:40mL;H+浓度:1.0mol/L。若设反应中硝酸既无挥发也无分解,则:
①参加反应的硝酸的物质的量为___。
②若已测出反应后E装置的生成物中含氮元素的质量,则为确定合金中铜的质量分数还需要测定的数据是___。
(6)若实验只测定 Cu的质量分数,不验证NO的产生,则在铜银合金中与浓硝酸反应后,只需要简单的实验操作可达到目的,请简述实验过程:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是制备重铬酸钾的实验装置示意图:
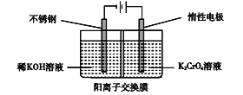
下列说法不正确的是
A.在阴极室,发生的电极反应为: 2H2O+2e- = 2OH -+ H2↑
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O向右移动
Cr2O72-(橙色)+H2O向右移动
C.该制备过程总反应为: 4K2CrO4 + 4H2O![]() 2K2Cr2O7 + 4KOH + 2H2↑+ O2↑
2K2Cr2O7 + 4KOH + 2H2↑+ O2↑
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比(nK/nCr)为d,则此时铬酸钾的转化率为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)水溶液中的离子平衡是中学化学中重要知识。
①常温下,0.001mol/LNaOH溶液的pH=____;
②(NH4)2SO4是一种重要的氮肥,长期施用会使土壤酸化,其原因是_______(用离子方程式表示);
③已知在25℃:AgCl(s) ![]() Ag+(aq)+Cl-(aq) Ksp=1.8×10-10,Ag2S(s)
Ag+(aq)+Cl-(aq) Ksp=1.8×10-10,Ag2S(s) ![]() 2Ag+(aq)+S2-(aq) Ksp=6.3×10-50,向KCl和K2S浓度均为0.001mol/L的混合溶液中,逐滴加入AgNO3溶液,最先产生的沉淀是_____(填“AgCl”或“Ag2S”)。
2Ag+(aq)+S2-(aq) Ksp=6.3×10-50,向KCl和K2S浓度均为0.001mol/L的混合溶液中,逐滴加入AgNO3溶液,最先产生的沉淀是_____(填“AgCl”或“Ag2S”)。
(2)甲醇是可再生能源,其燃烧热为726.5kJ·mol-1。下列能正确表示甲醇燃烧的热化学方程式的是____(填字母代号)。
A.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=+726.5kJ·mol-1
O2(g)=CO2(g)+2H2O(l) △H=+726.5kJ·mol-1
B.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=726.5kJ·mol-1
O2(g)=CO2(g)+2H2O(l) △H=726.5kJ·mol-1
C.CH3OH+![]() O2=CO2+2H2O △H=726.5kJ·mol-1
O2=CO2+2H2O △H=726.5kJ·mol-1
(3)800℃,向某恒容密闭容器中充入反应物A,发生反应2A(g) ![]() 2B(g)+C(g) △H<0。已知A的浓度随时间的变化如下:
2B(g)+C(g) △H<0。已知A的浓度随时间的变化如下:
反应时间((min) | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
c(A)(mol/L) | 1.0 | 0.80 | 0.67 | 0.58 | 0.43 | 0.50 | 0.50 |
请回答下列问题:
①在10-20min内,A的平均反应速率为________mol/(L.min);
②不能说明该反应达到化学平衡状态的是__________(填字母代号);
A.容器内气体密度不再变化 B.容器内气体平均摩尔质量不再变化 C.容器内气体的压强不再变化
③800℃时,平衡常数K=_________;
④若温度将为600℃,其平衡常数K将________(填“增大”、“减小”、或“不变”)。
(4)如图所示,闭合S后不久,可观察到滤纸a端附近呈蓝色,则:
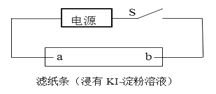
①滤纸b端与电源__________(填“正极”或“负 极”)相连;
②滤纸a端发生的电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】VCB是锂离子电池的一-种添加剂,以环氧乙烷(EO)为原料制备VCB的一种合成路线如下:
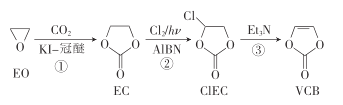
下列说法错误的是
A.反应①的原子利用率为100%
B.②的反应类型为取代反应.
C.EO、EC的一氯代物种数相同
D.CIEC、VCB分子中所有原子均处于同一平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com