
【题目】海水电池是我国1991年研制的以铝—空气—海水为能源的新型电池,可用于航海标志灯的供电。
(1)下列装置的模型,能体现海水电池工作原理的是_______(填字母)。
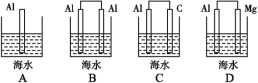
(2)海水电池工作过程中,负极的电极反应式为____,该极是电子___(填“流出”或“流入”)的一极,发生___反应。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】枸橼酸( )是一种弱有机酸,是柑橘类水果中产生的一种天然防腐剂,也是食物和饮料中的酸味添加剂。
)是一种弱有机酸,是柑橘类水果中产生的一种天然防腐剂,也是食物和饮料中的酸味添加剂。
(1)枸橼酸属于____(填“无机化合物”或“有机化合物”)。
(2)枸橼酸中含氧官能团有羧基和____(填名称)。
(3)向枸橼酸溶液中滴入2~3滴紫色石蕊试液,溶液颜色变红,说明枸橼酸溶液具有____性。
(4)1 mol枸橼酸最多消耗____mol NaOH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,硫酸盐 MSO4(M2+代表 Ba2+、Sr2+)的沉淀溶解平衡曲线如图所示。已知:p ( M2+ ) =-lgc ( M2+ ),p(SO42-)=-lgc(SO42-)。向 10mL 0.01 mol/L Na2SO4 溶液中滴入 1 滴(约 0. 05 mL) 0. 01 mol/L BaCl2 溶液岀现白色浑浊,而滴入 1 滴(约 0. 05 mL) 0. 01 mol/L SrCl2 溶液无浑浊出现。下列说法中错误的是
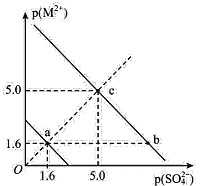
A.该温度下,溶度积常数 Ksp(BaSO4)<Ksp( SrSO4)
B.欲使c点对应BaSO4溶液移向b点,可加浓BaCl2溶液
C.欲使c点对应SrSO4溶液移向a点,可加浓SrCl2溶液
D.SrSO4(s)+Ba2+(aq)BaSO4(s)+Sr2+(aq)的平衡常数为106.8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国规定,所有销售的食品包装标签配料表上食品添加剂应使用规定的产品名称或种类名称,其中甜味剂、防腐剂、着色剂应注明。右图标签注明的添加剂中属于着色剂的是
①柠檬酸 ②山梨酸钾 ③甜味素
④菠萝香精 ⑤柠檬黄 ⑥日落黄

A.①②⑤B.②⑤⑥C.⑤⑥D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的两种或多种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积)。关于该固体混合物,下列说法正确的是

A. 一定含有Al,其质量为4.05g
B. 一定不含FeCl2,可能含有MgCl2和AlCl3
C. 一定含有MgCl2 和FeCl2
D. 一定含有(NH4)2SO4 和MgCl2,且物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式错误的是( )
A.硫代硫酸钠与稀硫酸的反应:S2O32-+6H++2SO42-![]() 4SO2↑+3H2O
4SO2↑+3H2O
B.用惰性电极电解饱和食盐水:2Cl-+2H2O![]() 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
C.醋酸钠溶液呈碱性的原因:CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
D.硫酸铜溶液遇到难溶的PbS转变为更难溶的CuS:Cu2++SO42-+PbS=CuS+PbSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是地壳中含量最高的金属元素,其单质及其化合物在生产生活中的应用十分广泛。
(1)铝原子最外层电子排布式是________,铝原子核外有___种能量不同的电子。
(2)1827年,德国化学家维勒用金属钾与无水氯化铝反应而制得了金属铝。不用钾与氯化铝溶液制铝的理由是_________;现代工业炼铝是以Al2O3为原料,与冰晶石(Na3A1F6)在熔融状态下进行电解,其阴极电极反应式为___________________________。
(3)用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如:2Al+4BaO![]() 3Ba↑+BaO·Al2O3,用化学平衡移动原理解释上述方法可制取金属Ba的原因是________。
3Ba↑+BaO·Al2O3,用化学平衡移动原理解释上述方法可制取金属Ba的原因是________。
(4)LiAlH4由Li+、A1H4-构成,是有机合成中常用的试剂,LiAlH4在125℃分解为LiH、H2和Al。
①比较Li+、 H-、Al3+、H+离子半径大小____________。
②写出LiAlH4分解的方程式(需配平)_______,若反应生成3.36 L氢气(标准状况下),则有____g铝生成。
③LiAlH4与乙醛反应可生成乙醇,推断LiAlH4是反应的_________剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO![]() 2CO2+N2(降温后该反应的平衡常数变大)为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2(降温后该反应的平衡常数变大)为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)(mol/L) | 1.00×10﹣3 | 4.50×10﹣4 | 2.50×10﹣4 | 1.50×10﹣4 | 1.00×10﹣4 | 1.00×10﹣4 |
c(CO)(mol/L) | 3.60×10﹣3 | 3.05×10﹣3 | 2.85×10﹣3 | 2.75×10﹣3 | 2.70×10﹣3 | 2.70×10﹣3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)反应的Q___0(填写“>”、“<”、“=”)。
(2)前2s内的平均反应速率v(N2)=___。
(3)计算在该温度下,反应的平衡常数K=___。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是___。
A.选用更有效的催化剂
B.升高反应体系的温度
C.降低反应体系的温度
D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
实验 编号 | T(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
Ⅱ | ___ | ___ | ___ | 124 |
Ⅲ | 350 | ___ | ___ | 124 |
①请在上表空格中填入剩余的实验条件数据。
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①25℃时,NaHCO3溶液呈碱性,原因是___________水解引起的(填“Na+”或“HCO3-”);
②常温下,0.0100mol/L 盐酸的pH=___________;
③用0.0100mol/L 盐酸滴定未知浓度的NaOH溶液,酚酞作指示剂,滴定终点时,溶液的颜色由浅红色变为___________(填“蓝色”或“无色”),且半分钟内保持不变。
(2)①已知H2与O2反应生成1mol H2O(g)时放出241.8kJ 的热量,请完成该反应的热化学方程式:2H2(g) +O2(g)=2H2O(g) △H=___________kJ/mol;
②已知:C(石墨,s)=C(金刚石,s) △H>0,则稳定性: 石墨___________金刚石 (填“>”、“<”或“=”)。
(3)在某密闭容器中进行可逆反应:FeO(s)+CO(g)![]() Fe(s)+CO2(g) △H>0,平衡常数表达式为K=
Fe(s)+CO2(g) △H>0,平衡常数表达式为K=![]() 。
。
①反应达到平衡后,向容器中通入CO,化学平衡向__________方向移动(填“正反应”或“逆反应”);
②若升高温度,平衡常数K___________(填“增大”、“减少”或“不变”);
③查阅资料得知1100℃时K=0.263。某时刻测得容器中c(CO2)=0.025 mol/L,c(CO)=0.10 mol/L,此时刻反应__________平衡状态(填“达到”或“未达到”)。
(4)电化学是研究化学能与电能相互转化的装置、过程和效率的科学。
①根据氧化还原反应:2Ag+(aq)+Cu(s)=2Ag(s)+Cu2+(aq),设计的原电池如图一所示,X溶液时__________溶液(填“CuSO4”或“AgNO3”);
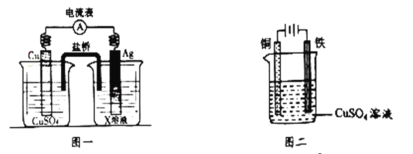
②图二装置在铁件上镀铜,铁作阴极,则铜极上的电极反应是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com