
【题目】我国规定,所有销售的食品包装标签配料表上食品添加剂应使用规定的产品名称或种类名称,其中甜味剂、防腐剂、着色剂应注明。右图标签注明的添加剂中属于着色剂的是
①柠檬酸 ②山梨酸钾 ③甜味素
④菠萝香精 ⑤柠檬黄 ⑥日落黄

A.①②⑤B.②⑤⑥C.⑤⑥D.③④
科目:高中化学 来源: 题型:
【题目】下列有关有机化合物的说法正确的是( )
A.间二甲苯苯环上的一个氢原子被“![]() ”取代时,形成的同分异构体最多有6种
”取代时,形成的同分异构体最多有6种
B.将等物质的量的![]() 与
与![]() 混合,在光照条件下充分反应可以制得纯净的氯乙烷
混合,在光照条件下充分反应可以制得纯净的氯乙烷
C.苯与液溴混合后加入铁粉,此时苯发生了加成反应
D.食物中的纤维素在人体内可以水解生成葡萄糖,为人类活动提供能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是分离混合物时常用的仪器,可以进行的混合物分离操作分别是()
![]()
A.蒸馏、过滤、萃取、蒸发B.蒸馏、蒸发、萃取、过滤
C.萃取、过滤、蒸馏、蒸发D.过滤、蒸发、萃取、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是一种高效清洁的火箭燃料,0.5 mol气态肼完全燃烧生成氮气和水蒸气时,放出267 kJ的热量,下列热化学方程式书写正确的是( )
A.N2H4(g)+O2(g)= N2(g)+2H2O(g) ΔH=+534 kJ/mol
B.![]() N2H4(g)+
N2H4(g)+![]() O2(g)=
O2(g)=![]() N2(g)+H2O(g) ΔH=-267 kJ/mol
N2(g)+H2O(g) ΔH=-267 kJ/mol
C.N2H4(g)+O2(g)= N2(g)+2H2O(g) ΔH=-534 kJ/mol
D.N2H4(g)+O2(g)= N2(g)+2H2O(l) ΔH=-534 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究氧化铜与硫的反应并分析反应后的固体产物,设计如下实验装置。
(1)如图连接实验装置,并_____。
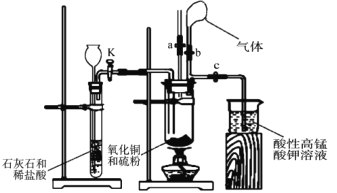
(2)将氧化铜粉末与硫粉按 5:1 质量比混合均匀。
(3)取适量氧化铜与硫粉的混合物装入大试管中,固定在铁架台上,打开_____ 和止水夹 a 并______,向长颈漏斗中加入稀盐酸,一段时间后,将燃着的木条放在止水夹 a 的上端导管口处,观察到木条熄灭,关闭活塞 K 和止水夹 a,打开止水夹 b。该实验步骤的作用是______,石灰石与稀盐酸反应的离子方程式为___________________。
(4)点燃酒精灯,预热大试管,然后对准大试管底部集中加热,一段时间后,气球膨胀, 移除酒精灯,反应继续进行。待反应结束,发现气球没有变小,打开止水夹 c,观察到酸性高锰酸钾溶液褪色后,立即用盛有氢氧化钠溶液的烧杯替换盛装酸性高锰酸钾溶液的烧杯,并打开活塞 K。这样操作的目的是__________________。
(5)拆下装置,发现黑色粉末混有砖红色粉末。取少量固体产物投入足量氨水中,得到无色溶液、但仍有红黑色固体未溶解,且该无色溶液在空气中逐渐变为蓝色。查阅资料得知溶液颜色变化是因为发生了以下反应:4[Cu(NH3)2]+ + O2+8NH3 H2O=4[Cu(NH3)4]2++4OH-+6H2O。
①经分析,固体产物中含有Cu2O。Cu2O 溶于氨水反应的离子方程式为______。
②仍有红色固体未溶解,表明氧化铜与硫除发生反应 4CuO + S![]() 2Cu2O+SO2外,还一定发生了其他反应,其化学方程式为_________。
2Cu2O+SO2外,还一定发生了其他反应,其化学方程式为_________。
③进一步分析发现 CuO 已完全反应,不溶于氨水的黑色固体可能是_____(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置不能完成相应实验的是
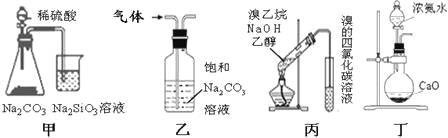
A.甲装置可比较硫、碳、硅三种元素的非金属性强弱
B.乙装置可除去CO2中少量的SO2杂质
C.丙装置可用于检验溴乙烷与NaOH的醇溶液共热产生的乙烯
D.丁装置可用于实验室制备氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水电池是我国1991年研制的以铝—空气—海水为能源的新型电池,可用于航海标志灯的供电。
(1)下列装置的模型,能体现海水电池工作原理的是_______(填字母)。
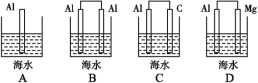
(2)海水电池工作过程中,负极的电极反应式为____,该极是电子___(填“流出”或“流入”)的一极,发生___反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠有多种化合物,如氧化钠、过氧化钠、氢氧化钠、碳酸钠、碳酸氢钠等等,这些物质在实际生活中有广泛的应用,一定条件下相互间能进行转化。
完成下列计算:
(1)将7.8克Na2O2完全溶解于93.8克水中,所得溶液的质量百分比浓度为______。
(2)将11.6克二氧化碳和水蒸汽的混合物与足量的Na2O2充分反应,固体质量增加了3.6克,则原混合气体的平均分子量为______。
(3)向100 mL NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M(不含结晶水)。通入二氧化碳的体积V(标准状况下)与M的质量W的关系如下图所示。
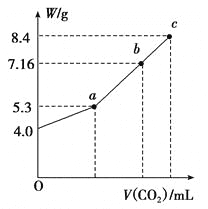
①推断b点时M的组成成份(写出计算过程)____________。
②若向b点的盐溶液中只加入0.03mol某钠的化合物,充分反应后,减压低温蒸发得到无水Na2CO3 8.48g,则加入的物质可以是________或_______。
(4)由31g NaOH和NaHCO3的固体混合物,在密闭密器中加热到250℃,经充分反应后排出气体、冷却,称得剩余固体的质量为N g,试分析不同N值时,剩余固体的组成成份(已知NaHCO3的分解温度低于250℃)。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)水溶液中的离子平衡是中学化学中重要知识。
①常温下,0.001mol/LNaOH溶液的pH=____;
②(NH4)2SO4是一种重要的氮肥,长期施用会使土壤酸化,其原因是_______(用离子方程式表示);
③已知在25℃:AgCl(s) ![]() Ag+(aq)+Cl-(aq) Ksp=1.8×10-10,Ag2S(s)
Ag+(aq)+Cl-(aq) Ksp=1.8×10-10,Ag2S(s) ![]() 2Ag+(aq)+S2-(aq) Ksp=6.3×10-50,向KCl和K2S浓度均为0.001mol/L的混合溶液中,逐滴加入AgNO3溶液,最先产生的沉淀是_____(填“AgCl”或“Ag2S”)。
2Ag+(aq)+S2-(aq) Ksp=6.3×10-50,向KCl和K2S浓度均为0.001mol/L的混合溶液中,逐滴加入AgNO3溶液,最先产生的沉淀是_____(填“AgCl”或“Ag2S”)。
(2)甲醇是可再生能源,其燃烧热为726.5kJ·mol-1。下列能正确表示甲醇燃烧的热化学方程式的是____(填字母代号)。
A.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=+726.5kJ·mol-1
O2(g)=CO2(g)+2H2O(l) △H=+726.5kJ·mol-1
B.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=726.5kJ·mol-1
O2(g)=CO2(g)+2H2O(l) △H=726.5kJ·mol-1
C.CH3OH+![]() O2=CO2+2H2O △H=726.5kJ·mol-1
O2=CO2+2H2O △H=726.5kJ·mol-1
(3)800℃,向某恒容密闭容器中充入反应物A,发生反应2A(g) ![]() 2B(g)+C(g) △H<0。已知A的浓度随时间的变化如下:
2B(g)+C(g) △H<0。已知A的浓度随时间的变化如下:
反应时间((min) | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
c(A)(mol/L) | 1.0 | 0.80 | 0.67 | 0.58 | 0.43 | 0.50 | 0.50 |
请回答下列问题:
①在10-20min内,A的平均反应速率为________mol/(L.min);
②不能说明该反应达到化学平衡状态的是__________(填字母代号);
A.容器内气体密度不再变化 B.容器内气体平均摩尔质量不再变化 C.容器内气体的压强不再变化
③800℃时,平衡常数K=_________;
④若温度将为600℃,其平衡常数K将________(填“增大”、“减小”、或“不变”)。
(4)如图所示,闭合S后不久,可观察到滤纸a端附近呈蓝色,则:
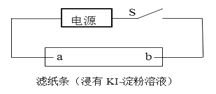
①滤纸b端与电源__________(填“正极”或“负 极”)相连;
②滤纸a端发生的电极反应式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com