
【题目】下列反应的离子方程式错误的是( )
A.硫代硫酸钠与稀硫酸的反应:S2O32-+6H++2SO42-![]() 4SO2↑+3H2O
4SO2↑+3H2O
B.用惰性电极电解饱和食盐水:2Cl-+2H2O![]() 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
C.醋酸钠溶液呈碱性的原因:CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
D.硫酸铜溶液遇到难溶的PbS转变为更难溶的CuS:Cu2++SO42-+PbS=CuS+PbSO4
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】已知A是一种金属, B溶液能使酚酞试液变红,且焰色反应呈黄色;D、F相遇会产生白烟,生成NH4Cl。A、B、C、D、E、F间有如下变化关系:
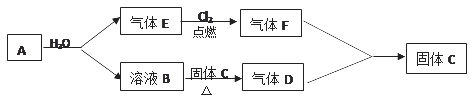
(1)A是________________;
(2)E在氯气中燃烧的实验现象是__________________;
(3)写出A→E、B反应的化学方程式:___________________;
(4)F在空气中遇水蒸气产生白雾现象,这白雾实际上是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是一种高效清洁的火箭燃料,0.5 mol气态肼完全燃烧生成氮气和水蒸气时,放出267 kJ的热量,下列热化学方程式书写正确的是( )
A.N2H4(g)+O2(g)= N2(g)+2H2O(g) ΔH=+534 kJ/mol
B.![]() N2H4(g)+
N2H4(g)+![]() O2(g)=
O2(g)=![]() N2(g)+H2O(g) ΔH=-267 kJ/mol
N2(g)+H2O(g) ΔH=-267 kJ/mol
C.N2H4(g)+O2(g)= N2(g)+2H2O(g) ΔH=-534 kJ/mol
D.N2H4(g)+O2(g)= N2(g)+2H2O(l) ΔH=-534 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置不能完成相应实验的是
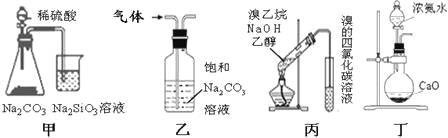
A.甲装置可比较硫、碳、硅三种元素的非金属性强弱
B.乙装置可除去CO2中少量的SO2杂质
C.丙装置可用于检验溴乙烷与NaOH的醇溶液共热产生的乙烯
D.丁装置可用于实验室制备氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水电池是我国1991年研制的以铝—空气—海水为能源的新型电池,可用于航海标志灯的供电。
(1)下列装置的模型,能体现海水电池工作原理的是_______(填字母)。
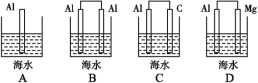
(2)海水电池工作过程中,负极的电极反应式为____,该极是电子___(填“流出”或“流入”)的一极,发生___反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼(![]() )、肼(
)、肼(![]() )和四氧化二氧(
)和四氧化二氧(![]() )可作为运载火箭的推进剂。
)可作为运载火箭的推进剂。
(1)已知:![]()
![]()
![]()
![]()
![]()
![]()
![]() 和
和![]() 反应生成
反应生成![]() 、
、![]() 和
和![]() 并放出大量热,写出该反应的热化学方程式(
并放出大量热,写出该反应的热化学方程式(![]() 用含
用含![]() 、
、![]() 、
、![]() 的代数式表示)__________。该反应______(填“是”或“不是”)自发反应,判断的理由是_______。
的代数式表示)__________。该反应______(填“是”或“不是”)自发反应,判断的理由是_______。
(2)肼(![]() )也可用于新型环保燃料电池中,燃料电池的工作原理示意图如图1所示,该燃料电池的负极反应式为_________________________________。
)也可用于新型环保燃料电池中,燃料电池的工作原理示意图如图1所示,该燃料电池的负极反应式为_________________________________。
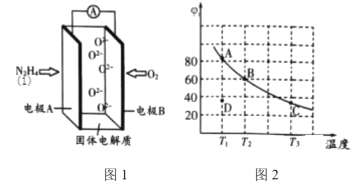
(3)将4molN2O4放入2 L,恒容密闭容器中发生反应N2O4(g) ![]() 2NO2(g),平衡体系中N2O4的体积分数(
2NO2(g),平衡体系中N2O4的体积分数(![]() )随温度的变化如图2所示
)随温度的变化如图2所示
①D点v(正)________v(逆)(填“>”“=”或“<”)。
②A、B、C点中平衡常数K的值最大的是________点。![]() 时,N2O4的平衡转化率为________;若达平衡时间为5 s,则此时间内的
时,N2O4的平衡转化率为________;若达平衡时间为5 s,则此时间内的![]() 平均反应速率为________。
平均反应速率为________。
③若其条件不变,在![]() 原平衡基础上,再加入一定量
原平衡基础上,再加入一定量![]() ,达到新平衡时,与原平衡相比,NO2的体积分数________(填“增大”“不变”或“减小”)。
,达到新平衡时,与原平衡相比,NO2的体积分数________(填“增大”“不变”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠有多种化合物,如氧化钠、过氧化钠、氢氧化钠、碳酸钠、碳酸氢钠等等,这些物质在实际生活中有广泛的应用,一定条件下相互间能进行转化。
完成下列计算:
(1)将7.8克Na2O2完全溶解于93.8克水中,所得溶液的质量百分比浓度为______。
(2)将11.6克二氧化碳和水蒸汽的混合物与足量的Na2O2充分反应,固体质量增加了3.6克,则原混合气体的平均分子量为______。
(3)向100 mL NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M(不含结晶水)。通入二氧化碳的体积V(标准状况下)与M的质量W的关系如下图所示。
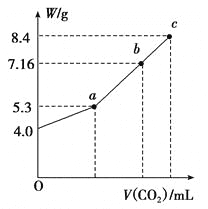
①推断b点时M的组成成份(写出计算过程)____________。
②若向b点的盐溶液中只加入0.03mol某钠的化合物,充分反应后,减压低温蒸发得到无水Na2CO3 8.48g,则加入的物质可以是________或_______。
(4)由31g NaOH和NaHCO3的固体混合物,在密闭密器中加热到250℃,经充分反应后排出气体、冷却,称得剩余固体的质量为N g,试分析不同N值时,剩余固体的组成成份(已知NaHCO3的分解温度低于250℃)。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲用浓硝酸法(测定反应后生成气体的量)测定某铜银合金中铜的质量分数,但资料表明:反应中除了生成NO2气体外还会有少量的NO生成;常温下NO2和N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在。为完成测定并验证确有NO生成,有人设计如下实验:
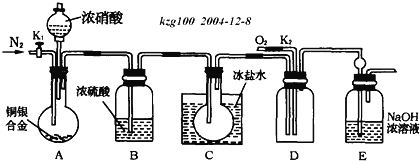
(1)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是___。
(2)装置B瓶的作用是___。
(3)A中的反应停止后,打开D中的活塞K2,并通入氧气,若反应确有NO产生,则D中应出现的现象是___;实验发现,通入氧气温度的高低对实验现象有较大影响,则为便于观察应通入___(填“冷”或“热”)的氧气。
(4)为减小测量误差,在A中反应完成和D中出现现象后,还应继续进行的操作是___。
(5)实验测得下列数据:所用铜银合金质量:15.0g、浓硝酸:40mL13.5mol/L;实验后A中溶液体积:40mL;H+浓度:1.0mol/L。若设反应中硝酸既无挥发也无分解,则:
①参加反应的硝酸的物质的量为___。
②若已测出反应后E装置的生成物中含氮元素的质量,则为确定合金中铜的质量分数还需要测定的数据是___。
(6)若实验只测定 Cu的质量分数,不验证NO的产生,则在铜银合金中与浓硝酸反应后,只需要简单的实验操作可达到目的,请简述实验过程:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.铝的第一电离能比镁的第一电离能大
B.同一主族元素从上到下电负性逐渐变大
C.镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态
D.最外层电子数是核外电子总数![]() 的原子和最外层电子排布式为4s24p5的原子是同种元素原子
的原子和最外层电子排布式为4s24p5的原子是同种元素原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com