
【题目】偏二甲肼(![]() )、肼(
)、肼(![]() )和四氧化二氧(
)和四氧化二氧(![]() )可作为运载火箭的推进剂。
)可作为运载火箭的推进剂。
(1)已知:![]()
![]()
![]()
![]()
![]()
![]()
![]() 和
和![]() 反应生成
反应生成![]() 、
、![]() 和
和![]() 并放出大量热,写出该反应的热化学方程式(
并放出大量热,写出该反应的热化学方程式(![]() 用含
用含![]() 、
、![]() 、
、![]() 的代数式表示)__________。该反应______(填“是”或“不是”)自发反应,判断的理由是_______。
的代数式表示)__________。该反应______(填“是”或“不是”)自发反应,判断的理由是_______。
(2)肼(![]() )也可用于新型环保燃料电池中,燃料电池的工作原理示意图如图1所示,该燃料电池的负极反应式为_________________________________。
)也可用于新型环保燃料电池中,燃料电池的工作原理示意图如图1所示,该燃料电池的负极反应式为_________________________________。
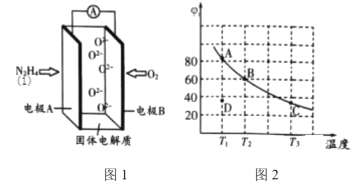
(3)将4molN2O4放入2 L,恒容密闭容器中发生反应N2O4(g) ![]() 2NO2(g),平衡体系中N2O4的体积分数(
2NO2(g),平衡体系中N2O4的体积分数(![]() )随温度的变化如图2所示
)随温度的变化如图2所示
①D点v(正)________v(逆)(填“>”“=”或“<”)。
②A、B、C点中平衡常数K的值最大的是________点。![]() 时,N2O4的平衡转化率为________;若达平衡时间为5 s,则此时间内的
时,N2O4的平衡转化率为________;若达平衡时间为5 s,则此时间内的![]() 平均反应速率为________。
平均反应速率为________。
③若其条件不变,在![]() 原平衡基础上,再加入一定量
原平衡基础上,再加入一定量![]() ,达到新平衡时,与原平衡相比,NO2的体积分数________(填“增大”“不变”或“减小”)。
,达到新平衡时,与原平衡相比,NO2的体积分数________(填“增大”“不变”或“减小”)。
【答案】C2H8N2(l)+2N2O4(l)=3N2(g)+2H2O(g)+2CO2(g) △H=△H 1-△H 2-△H3 是 正反应方向是熵增的放热反应,△H-T△S恒小于0 N2H4-4e- +2O2-=N2+2H2O < C 25% 0.1molL-1S-1 减小
【解析】
(1)已知:①![]()
![]() ,②
,②![]()
![]() ,③
,③![]()
![]() ,由盖斯定律可知①-②-③得C2H8N2(l)+2N2O4(l)=3N2(g)+2H2O(g)+2CO2(g),据此计算△H,再结合△G=△H-T△S分析反应能否自发进行;
,由盖斯定律可知①-②-③得C2H8N2(l)+2N2O4(l)=3N2(g)+2H2O(g)+2CO2(g),据此计算△H,再结合△G=△H-T△S分析反应能否自发进行;
(2)燃料电池通O2的极为正极,则通N2H4的极为负极,发生氧化反应,产物为N2;
(3)①由图可知,D点未达到平衡状态,A点达到平衡状态,D→A时反应物N2O4的体积分数增大,即反应逆向进行;
②图2可知,随温度升高,平衡时N2O4的体积分数不断减小,说明温度升高平衡正向移动,平衡常数随温度的升高而增大;T2平衡时N2O4的体积分数为60%;
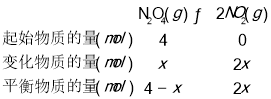
则:![]() =60%,解得:x=1,由此计算N2O4的转化率和平均反应速率;
=60%,解得:x=1,由此计算N2O4的转化率和平均反应速率;
③若其条件不变,在![]() 原平衡基础上,再加入一定量
原平衡基础上,再加入一定量![]() ,NO2的浓度增大,平衡逆向移动。
,NO2的浓度增大,平衡逆向移动。
(1)已知:①![]()
![]() ,②
,②![]()
![]() ,③
,③![]()
![]() ,由盖斯定律可知①-②-③得C2H8N2(l)+2N2O4(l)=3N2(g)+2H2O(g)+2CO2(g),则△H=△H 1-△H 2-△H3,因此反应正反应为放热反应,即△H<0,且为熵增反应,即△S>0,则△G=△H-T△S恒小于0,说明此反应是自发反应;
,由盖斯定律可知①-②-③得C2H8N2(l)+2N2O4(l)=3N2(g)+2H2O(g)+2CO2(g),则△H=△H 1-△H 2-△H3,因此反应正反应为放热反应,即△H<0,且为熵增反应,即△S>0,则△G=△H-T△S恒小于0,说明此反应是自发反应;
(2)燃料电池通O2的极为正极,则通N2H4的极为负极,发生氧化反应,产物为N2,且燃料电池工作时O2-向负极移动,则该燃料电池的负极反应式为N2H4-4e- +2O2-=N2+2H2O;
(3)①由图可知,D点未达到平衡状态,A点达到平衡状态,D→A时反应物N2O4的体积分数增大,反应逆向进行,即v正<V逆;
②图2可知,随温度升高,平衡时N2O4的体积分数不断减小,说明温度升高平衡正向移动,平衡常数随温度的升高而增大,即A、B、C点中平衡常数K的值最大的是C点;T2平衡时N2O4的体积分数为60%;
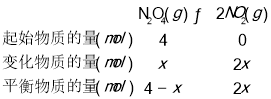
则:![]() =60%,解得:x=1,故N2O4的转化率为
=60%,解得:x=1,故N2O4的转化率为![]() =25%;若达到平衡所需要的时间为5s,则此时间内的
=25%;若达到平衡所需要的时间为5s,则此时间内的![]() 平均反应速率为
平均反应速率为![]() =0.1molL-1S-1;
=0.1molL-1S-1;
③若其条件不变,在![]() 原平衡基础上,再加入一定量NO2,NO2的浓度增大,平衡逆向移动,达到新平衡时,与原平衡相比,NO2的体积分数将减小。
原平衡基础上,再加入一定量NO2,NO2的浓度增大,平衡逆向移动,达到新平衡时,与原平衡相比,NO2的体积分数将减小。


科目:高中化学 来源: 题型:
【题目】室温下,某同学进行CO2与Na2O2反应的探究实验,回答下列问题。
(1)用如图装置制备纯净的CO2
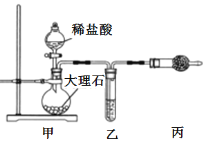
①丙装置的名称是___,乙装置中盛装的试剂是___。
②若CO2 中混有HCl,则HCl与Na2O2反应的化学方程式为____。
(2)按照下面的装置图进行实验(夹持装置略)。
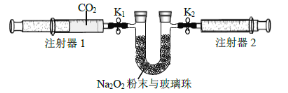
①先组装仪器,然后________,再用注射器1抽取100mL 纯净的CO2,将其连接在K1 处,注射器2的活塞推到底后连接在K2 处,具支U 形管中装入足量的Na2O2 粉末与玻璃珠。
②打开止水夹K1、K2,向右推动注射器1的活塞,可观察到的现象是_____。
③实验过程中反应的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有五种元素X、Y、Z、Q、T。X元素为主族元素,X原子的M层上有两个未成对电子且无空轨道;Y原子的价电子排布式为3d64s2;Z原子的![]() 电子层的p能级上有一个空轨道;Q原子的L电子层的p能级上只有一对成对电子;T原子的M电子层上p轨道半充满。下列叙述不正确的是( )
电子层的p能级上有一个空轨道;Q原子的L电子层的p能级上只有一对成对电子;T原子的M电子层上p轨道半充满。下列叙述不正确的是( )
A.元素Y和Q可形成化合物Y2Q3
B.X与![]() 的最高价氧化物对应的水化物,前者的酸性比后者强
的最高价氧化物对应的水化物,前者的酸性比后者强
C.X和Q结合生成的化合物为离子化合物
D.ZQ2是由极性键构成的非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家一直致力于“人工固氮”的方法研究。
(1)合成氨的原理为:N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)![]() H=-92.4 kJ/mol,该反应的能量变化如图所示。
H=-92.4 kJ/mol,该反应的能量变化如图所示。
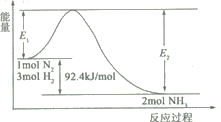
①在反应体系中加入催化剂,反应速率增大,E2的变化是___(填“增大”、“减小”或“不变”)。
②将0.3 mol N2和0.5 mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,测得容器内气体压强变为原来的![]() ,此时H2的转化率为___;欲提高该容器中H2的转化率,下列措施可行的是___(填选项字母)。
,此时H2的转化率为___;欲提高该容器中H2的转化率,下列措施可行的是___(填选项字母)。
A.向容器中按原比例再充入原料气 | B.向容器中再充入一定量H2 |
C.改变反应的催化剂 | D.液化生成物分离出氨 |
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生反应:
2N2(g)+6H2O(1)![]() 4NH3(g)+3O2(g)
4NH3(g)+3O2(g)![]() H=+1530 kJ/mol
H=+1530 kJ/mol
又知:H2O(1)=H2O(g)![]() H=+44.0 kJ/mol
H=+44.0 kJ/mol
则2N2(g)+6H20(g)![]() 4NH3(g)+302(g)
4NH3(g)+302(g)![]() H =___kJ/mol,该反应的化学平衡常数表达式为K=_______,控制其他条件不变,增大压强,K值___(填“增大”、“减小”或“不变”)。
H =___kJ/mol,该反应的化学平衡常数表达式为K=_______,控制其他条件不变,增大压强,K值___(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表所列是五种短周期元素的原子半径及主要化合价(已知铍的原子半径为0.089 nm)。
元素代号 | A | B | C | D | E |
原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
(1)用元素代号标出它们在周期表中所对应的位置(以下为周期表的一部分)_________。
(2)画出A的原子结构示意图_________。
(3)B元素处于周期表中第________周期,________族。
(4)E元素处于周期表中第________周期,________族。
(5)C、D的简单离子的半径由大到小顺序为________(用离子符号表示)。
(6)上述五种元素的最高价氧化物对应的水化物中酸性最强的是__________(填化学式)。
(7)C、E形成的化合物为________(填化学式)。
(8)写出B单质和氢氧化钠溶液反应的方程式__________写出B的最高价氧化物对应水化物和氢氧化钠溶液反应的离子方程式:________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E四种元素,它们原子的核电荷数均小于18,且依次递增,A原子核内仅有一个质子;B原子的电子总数与D原子的最外层电子数相等;A原子与B原子的最外层电子数之和与C原子的最外层电子数相等;D的最外层电子数是次外层电子数的3倍;E的单质是用途最广泛的半导体材料。试推断它们各是什么元素并回答下列问题:
(1)写出它们的元素符号:A________,B________,C________,D________,E________。
(2)B、C、D的气态氢化物的稳定性由大到小的顺序为__________(用化学式表示)
(3)画出D的离子结构示意图________。
(4)用一个方程式证明B、E的非金属性的强弱_______________。
(5)写出E的最高价氧化物的一种用途:_________。
(6)由这五种元素组成的三核10电子的分子为________,四核10电子的分子是________。由这五种元素组成的四核18电子的分子为________,五核18电子的分子是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2N-NH2)和偏二甲肼[H2N-N(CH3)2]均可用作火箭燃料。查阅资料得知,肼是一种良好的极性溶剂,沿肼分子球棍模型的氮、氮键方向观察,看到的平面图如下图所示。下列说法不正确的是
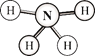
A.肼分子中的氮原子采用sp3杂化
B.肼分子中既有极性键又有非极性键
C.肼分子是非极性分子
D.肼与偏二甲肼互称同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等电子体的结构相似、物理性质相近,称为等电子原理。如N2和CO为等电子体。
(1)由第二周期元素组成,与F2互为等电子体的离子是____,与C2O42-互为等电子体的分子是____。
(2)Mn原子在元素周期表中的位置是____,价电子排布为____。
(3)往CuSO4溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。该离子的结构式为____,已知NF3与NH3的立体构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是:____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com