
【题目】肼(H2N-NH2)和偏二甲肼[H2N-N(CH3)2]均可用作火箭燃料。查阅资料得知,肼是一种良好的极性溶剂,沿肼分子球棍模型的氮、氮键方向观察,看到的平面图如下图所示。下列说法不正确的是
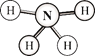
A.肼分子中的氮原子采用sp3杂化
B.肼分子中既有极性键又有非极性键
C.肼分子是非极性分子
D.肼与偏二甲肼互称同系物
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种烃,具有下列性质:
①各取0.1mol分别充分燃烧,其中B、C、E燃烧所得的CO2均为4.48L(标准状况),A和D燃烧所得的CO2都是前三者的3倍;
②在适宜条件下,A、B、C都能跟氢气发生加成反应,其中A可以转化为D、B可以转化为C,C可以转化为E;
③B和C都能使溴水或酸性KMnO4溶液褪色,而A、D、E无此性质;
④用铁屑作催化剂时,A可与溴发生取代反应。
(1)判断A、B、D、E各是什么物质,写出下列物质的结构简式:A_______B_______C_______D________E________。
(2)物质E的四氯代物有______种。
(3)写出C与溴的四氯化碳溶液反应的化学方程式:_______
(4)写出④中涉及的化学方程式:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼(![]() )、肼(
)、肼(![]() )和四氧化二氧(
)和四氧化二氧(![]() )可作为运载火箭的推进剂。
)可作为运载火箭的推进剂。
(1)已知:![]()
![]()
![]()
![]()
![]()
![]()
![]() 和
和![]() 反应生成
反应生成![]() 、
、![]() 和
和![]() 并放出大量热,写出该反应的热化学方程式(
并放出大量热,写出该反应的热化学方程式(![]() 用含
用含![]() 、
、![]() 、
、![]() 的代数式表示)__________。该反应______(填“是”或“不是”)自发反应,判断的理由是_______。
的代数式表示)__________。该反应______(填“是”或“不是”)自发反应,判断的理由是_______。
(2)肼(![]() )也可用于新型环保燃料电池中,燃料电池的工作原理示意图如图1所示,该燃料电池的负极反应式为_________________________________。
)也可用于新型环保燃料电池中,燃料电池的工作原理示意图如图1所示,该燃料电池的负极反应式为_________________________________。
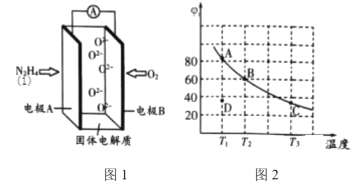
(3)将4molN2O4放入2 L,恒容密闭容器中发生反应N2O4(g) ![]() 2NO2(g),平衡体系中N2O4的体积分数(
2NO2(g),平衡体系中N2O4的体积分数(![]() )随温度的变化如图2所示
)随温度的变化如图2所示
①D点v(正)________v(逆)(填“>”“=”或“<”)。
②A、B、C点中平衡常数K的值最大的是________点。![]() 时,N2O4的平衡转化率为________;若达平衡时间为5 s,则此时间内的
时,N2O4的平衡转化率为________;若达平衡时间为5 s,则此时间内的![]() 平均反应速率为________。
平均反应速率为________。
③若其条件不变,在![]() 原平衡基础上,再加入一定量
原平衡基础上,再加入一定量![]() ,达到新平衡时,与原平衡相比,NO2的体积分数________(填“增大”“不变”或“减小”)。
,达到新平衡时,与原平衡相比,NO2的体积分数________(填“增大”“不变”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种有机醚,可由链烃A(分子式为C4H6)通过如图路线制得,下列说法正确的是
是一种有机醚,可由链烃A(分子式为C4H6)通过如图路线制得,下列说法正确的是
A![]() B
B![]() C
C![]()
![]()
A.A的结构简式是CH2═CHCH2CH3
B.B中含有的官能团有溴原子、碳碳双键
C.C在Cu或Ag做催化剂、加热条件下能被O2氧化为醛
D.①②③的反应类型分别为加成反应、取代反应、消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法错误的是( )
A.1 mol![]() OD- 离子含有的质子、中子数均为9NA
OD- 离子含有的质子、中子数均为9NA
B.3.6 g石墨和C60的混合物中,含有的碳原子数为0.3NA
C.含有4.6 g钠元素的过氧化钠和氧化钠的混合物中,所含离子总数为0.3NA
D.标准状况下,4.48 L戊烷含有的分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z为元素周期表中的短周期元素,它们在周期表中的位置关系如图所示,下列推断正确的是

A.无法推断出X、Y、Z的具体元素
B.Y可能是F元素
C.Z的最高价氧化物对应水化物的酸性比Y的强
D.X、Y两种元素形成的最简单化合物比X、Z形成的最简单化合物稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是中学化学中常见的三种元素(A、B、C代表元素符号)。A位于元素周期表中第四周期,其基态原子最外层电子数为2,且内层轨道全部排满电子。短周期元素B的一种常见单质为淡黄色粉末。元素C的原子最外层电子数是其内层电子数的3倍。
(1)在第三周期中,第一电离能大于B的元素有____种。
(2)B的氢化物(H2B)分子的立体构型为____,C的氢化物H2C、H2C2中C的杂化类型分别是________、____,在乙醇中的溶解度:S(H2C)>S(H2B),其原因是____。
(3)A的氯化物与氨水反应可形成配合物[A(NH3)4]Cl2,1mol该配合物中含有σ键的物质的量为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究硫酸亚铁的分解产物,进行了如下图装置所示的实验,打开K1和K2,缓缓通入N2,一段时间后加热,实验后反应管中残留固体为红色粉末,BaCl2溶液中有白色沉淀产生,品红溶液中红色褪去,检查氢氧化钠溶液出口处无氧气产生。下列说法错误的是

A. 氢氧化钠溶液的作用是吸收多余的SO2气体
B. 反应管内产生的红色粉末可能是Fe2O3
C. BaCl2溶液的目的是检验SO3的存在,此处用Ba(NO3)2溶液也可以检验SO3
D. 反应管内得到的氧化产物和还原产物物质的量之比为1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com