
【题目】下列关于物质性质递变规律的叙述不正确的是( )
A.单质的还原性:![]()
B.单质的氧化性:![]()
C.含氧酸的酸性:![]()
D.氢化物的稳定性:![]()
 新课标同步训练系列答案
新课标同步训练系列答案科目:高中化学 来源: 题型:
【题目】中国传统文化是人类文明的瑰宝,古代文献中记载了大量古代化学的研究成果。回答下面问题:
(1)我国最原始的陶瓷约出现在距今12000年前,制作瓷器所用的原料是高岭士,其晶体化学式是Al4[Si4O10](OH)8,用氧化物表示其组成为______________。
(2)《本草纲目》中记载:“(火药)乃焰消( KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者。”反应原理为:S+2KNO3+3C![]() K2S+N2↑+3CO2↑,该反应的氧化剂是_________ ,反应转移4mol电子时,被S氧化的C有____________mol。
K2S+N2↑+3CO2↑,该反应的氧化剂是_________ ,反应转移4mol电子时,被S氧化的C有____________mol。
(3)我国古代中药学著作《新修本草》记载的药物有844种,其中有关“青矾”的描述为:“本来绿色,新出窟未见风者,正如瑁璃…烧之赤色…。”我国早期科技丛书《物理小适-金石类》 记载有加热青矾时的景象:“青矾厂气熏人,衣服当之易烂,载木不盛。”青矾就是绿矾( FeSO4·7H2O)。根据以上信息,写出“青矾”受热分解的化学方程式_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表所列是五种短周期元素的原子半径及主要化合价(已知铍的原子半径为0.089 nm)。
元素代号 | A | B | C | D | E |
原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
(1)用元素代号标出它们在周期表中所对应的位置(以下为周期表的一部分)_________。
(2)画出A的原子结构示意图_________。
(3)B元素处于周期表中第________周期,________族。
(4)E元素处于周期表中第________周期,________族。
(5)C、D的简单离子的半径由大到小顺序为________(用离子符号表示)。
(6)上述五种元素的最高价氧化物对应的水化物中酸性最强的是__________(填化学式)。
(7)C、E形成的化合物为________(填化学式)。
(8)写出B单质和氢氧化钠溶液反应的方程式__________写出B的最高价氧化物对应水化物和氢氧化钠溶液反应的离子方程式:________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤代烃在工农业生产及人们的生活中具有广泛的用途,可用作灭火剂(如四氯化碳)、冷冻剂(如氟利昂)、麻醉剂(如氯仿,现已不使用),以及高分子工业的原料(如氯乙烯、四氟乙烯)等。卤代烃化学性质比较活泼,能发生取代反应、消去反应等,从而转化成其他类型的化合物,在有机合成中起着重要的桥梁作用。已知下面三个反应(其中A为氯代烃,B为烯烃)
反应① A![]() B
B
反应② B![]() CH3COOH+CO2↑+H2O
CH3COOH+CO2↑+H2O
反应③ CH3CH2CH=CH2+HBr![]() CH3CH2CH2CH2Br
CH3CH2CH2CH2Br
(注: RCH=CH2![]() RCOOH+CO2↑+H2O)
RCOOH+CO2↑+H2O)
请回答下列问题:
(1)化合物B的分子式为____,1mol化合物B完全燃烧需要消耗标准状况下____L的氧气。
(2)由丙醇可以制备B,该反应的反应条件为________,反应类型为________。
(3)假设A在核磁共振氢谱中有两组峰,且峰面积之比为6:1,那么A在氢氧化钾水溶液中加热反应生成的有机化合物的结构简式为________。
(4)写出B在有机过氧化物(R—O—O—R)中与HBr反应的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2N-NH2)和偏二甲肼[H2N-N(CH3)2]均可用作火箭燃料。查阅资料得知,肼是一种良好的极性溶剂,沿肼分子球棍模型的氮、氮键方向观察,看到的平面图如下图所示。下列说法不正确的是
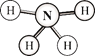
A.肼分子中的氮原子采用sp3杂化
B.肼分子中既有极性键又有非极性键
C.肼分子是非极性分子
D.肼与偏二甲肼互称同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员采用新型锰催化体系,选择性实现了简单酮与亚胺的芳环惰性C-H的活化反应。利用该反应制备化合物J的合成路线如下:

已知:
回答下列问题:
(1)A中官能团的名称是______。F的化学名称是______。
(2)C和D生成E的化学方程式为_____________。
(3)G的结构简式为________。
(4)由D生成F,E和H生成J的反应类型分别是______、_____。
(5)芳香化合物K是E的同分异构体。若K能发生银镜反应,则K可能的结构有____种,其中核磁共振氢谱有四组峰的结构简式为______(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
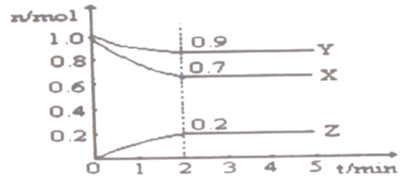
(1)该反应的化学方程式为____
(2)反应开始至2min,以Z表示的平均反应速率为____
(3)该反应为放热反应,能使该反应的反应速率增大的是____
A.及时分离出Z气体 B.适当降低温度 C.增大Y的浓度 D.选择高效催化剂
(4)2min后反应达到平衡,此时容器内混合气体的平均相对分子质量比起始投料时____(填“增大”“减小”或“相等”)
(5)可以判断上述反应已经达到平衡的是____
A.密闭容器中总压强不变
B.密闭容器中混合气体的密度不变
C.混合气体的平均相对分子质量不再改变
D.n(A):n(B):n(C)等于化学计量系数之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 是四种短周期元素,它们的核电荷数依次增大,四种元素的性质或原子结构的部分信息如表所示。
是四种短周期元素,它们的核电荷数依次增大,四种元素的性质或原子结构的部分信息如表所示。
元素 | 元素性质或原子结构的部分信息 |
| 元素的离子核外无电子 |
| 地壳中含量最多的元素 |
| 元素的离子半径在该周期中最小 |
|
|
下列叙述不正确的是( )
A.![]() 与
与![]() 形成的化合物在常温下为气体
形成的化合物在常温下为气体
B.![]() 的最高价氧化物对应的水化物不与
的最高价氧化物对应的水化物不与![]() 溶液反应
溶液反应
C.![]() 和
和![]() 形成的常见化合物能形成酸雨
形成的常见化合物能形成酸雨
D.简单氢化物的稳定性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸盐(如ZnS2O4)在工业中用作漂白剂、解毒剂、吸氧剂等,用途十分广泛。
Ⅰ.制取ZnS2O4溶液和晶体
控制3545℃进行反应,原理为:Zn+2SO2=ZnS2O4。
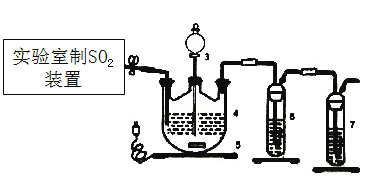
(1)下列四种制备SO2的方案中最佳选择是___________。
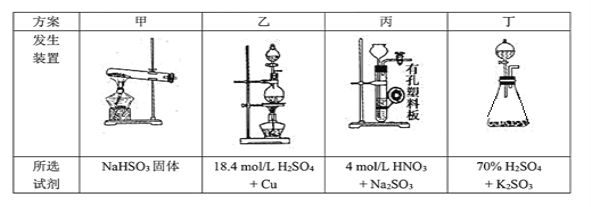
(2)停止电加热,仪器3放入一定量乙醇,制得ZnS2O4晶体,主要原因是_________。
Ⅱ.测定产率
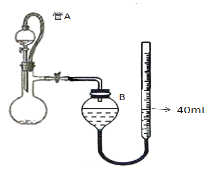
(3)仪器4中加入mg锌粉与一定量的水,电加热并启动磁力搅拌器5。一段时间后,待固体物质完全消失时,关闭活塞和止水夹。取ZnS2O4晶体的十分之一放于真空容器中,加适量的水、通适量氧气使其恰好转化为Zn(HSO4)2和Zn(HSO3)2固体,然后加入足量的硫酸,通过测定生成气体的体积来求算ZnS2O4晶体的产率。请回答下列相关问题:
①测定装置中,导管A的作用:一是________;二是________。
②为提高测定的准确度,仪器B中最宜选用_____________。
A.饱和食盐水 B.饱和NaHSO3溶液 C. 饱和澄清石灰水 D.98.3%的浓硫酸
③用图中量气管读数为起点,若终点读数为17.60mL,且实验温度下气体摩尔体积为VmL.mol-1,可得出ZnS2O4的产率为 ____________%。
(4)如果反应温度超过45℃,会导致ZnS2O4分解,仪器4中有黄色沉淀、白色沉淀且伴随着气泡生成,则ZnS2O4分解的化学方程式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com