
【题目】连二亚硫酸盐(如ZnS2O4)在工业中用作漂白剂、解毒剂、吸氧剂等,用途十分广泛。
Ⅰ.制取ZnS2O4溶液和晶体
控制3545℃进行反应,原理为:Zn+2SO2=ZnS2O4。
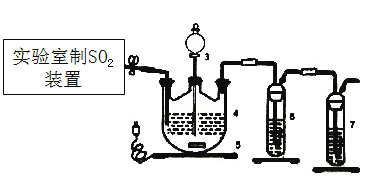
(1)下列四种制备SO2的方案中最佳选择是___________。
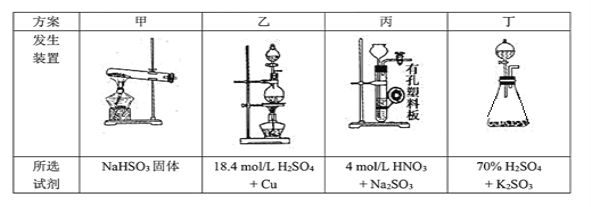
(2)停止电加热,仪器3放入一定量乙醇,制得ZnS2O4晶体,主要原因是_________。
Ⅱ.测定产率
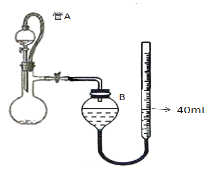
(3)仪器4中加入mg锌粉与一定量的水,电加热并启动磁力搅拌器5。一段时间后,待固体物质完全消失时,关闭活塞和止水夹。取ZnS2O4晶体的十分之一放于真空容器中,加适量的水、通适量氧气使其恰好转化为Zn(HSO4)2和Zn(HSO3)2固体,然后加入足量的硫酸,通过测定生成气体的体积来求算ZnS2O4晶体的产率。请回答下列相关问题:
①测定装置中,导管A的作用:一是________;二是________。
②为提高测定的准确度,仪器B中最宜选用_____________。
A.饱和食盐水 B.饱和NaHSO3溶液 C. 饱和澄清石灰水 D.98.3%的浓硫酸
③用图中量气管读数为起点,若终点读数为17.60mL,且实验温度下气体摩尔体积为VmL.mol-1,可得出ZnS2O4的产率为 ____________%。
(4)如果反应温度超过45℃,会导致ZnS2O4分解,仪器4中有黄色沉淀、白色沉淀且伴随着气泡生成,则ZnS2O4分解的化学方程式为________。
【答案】丁 乙醇使连二亚硫酸锌溶解度降低而析出 平衡气压使液体顺利流下 消除因硫酸的体积引起的误差 B ![]() 2ZnS2O4=S↓+SO2↑+2ZnSO3↓
2ZnS2O4=S↓+SO2↑+2ZnSO3↓
【解析】
(1)实验室制取二氧化硫使用70%的浓硫酸与亚硫酸钠固体;
(2)向溶液中加入乙醇,可降低ZnS2O4的溶解度;
(3)①导管a连接分馏烧瓶和分液漏斗,可使烧瓶中的压强与分液漏斗中压强相同;
②为防止二氧化硫溶于水或与水反应,装置B中的液体为饱和NaHSO3溶液;
③根据Zn~ZnS2O4~SO2计算。
(4)根据题意可知,温度超过45℃时,有单质硫、二氧化硫及亚硫酸锌生成。
(1)实验室制取二氧化硫的最佳方法用丁制取,优点为产量高,简单易行;
(2)向溶液中加入乙醇,可降低ZnS2O4的溶解度,从而得到晶体;
(3)①导管a连接分馏烧瓶和分液漏斗,可使烧瓶中的压强与分液漏斗中压强相同,使液体顺利流下,还可使容器内的总体积不变,消除因硫酸的体积引起的误差;
②为防止二氧化硫溶于水或与水反应,装置B中的液体为饱和NaHSO3溶液,答案为B;
③根据Zn~ZnS2O4~SO2,生成SO2的体积为40-17.6=22.4mL,n(SO2)=![]() mol,ZnS2O4的产率为
mol,ZnS2O4的产率为![]() ×100%;
×100%;
(4)根据题意可知,温度超过45℃时,有单质硫、二氧化硫及亚硫酸锌生成,则方程式为2ZnS2O4=S↓+SO2↑+2ZnSO3↓。


科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
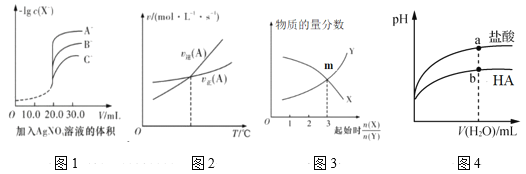
A.用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均与Ag+反应生成沉淀),由图1可确定首先沉淀的是C-
B.图2表示反应中某反应物的正、逆反应速率随温度变化的情况, 由图可知该反应的正反应是吸热反应
C.图3表示一定条件下,X(g)![]() Y(g)+Z(s)中物质的量分数随起始投料比变化。m点对应的X转化率为33.3%
Y(g)+Z(s)中物质的量分数随起始投料比变化。m点对应的X转化率为33.3%
D.图4表示常温下稀释pH相同的HA与盐酸时溶液pH与加入水体积的关系,则HA为弱酸,且a点Kw的数值比b点的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向1.00L0.3mol/L的NaOH溶液中缓慢通入CO2气体至溶液增重8.8g,所得溶液中( )
A.溶质为Na2CO3
B.溶质为Na2CO3、NaHCO3
C.![]() c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
D.c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究硫酸亚铁的分解产物,进行了如下图装置所示的实验,打开K1和K2,缓缓通入N2,一段时间后加热,实验后反应管中残留固体为红色粉末,BaCl2溶液中有白色沉淀产生,品红溶液中红色褪去,检查氢氧化钠溶液出口处无氧气产生。下列说法错误的是

A. 氢氧化钠溶液的作用是吸收多余的SO2气体
B. 反应管内产生的红色粉末可能是Fe2O3
C. BaCl2溶液的目的是检验SO3的存在,此处用Ba(NO3)2溶液也可以检验SO3
D. 反应管内得到的氧化产物和还原产物物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100mL0.5mol/L的NaOH溶液中通入一定量的CO2,测得反应后的溶液中CO32-和HCO3-的物质的量浓度之比为1∶3,则通入的CO2气体在标准状况下的体积是________________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物6.4g在氧气中完全燃烧,只生成8.8g CO2和7.2 g H2O。下列说法正确的是
A. 该化合物仅含碳、氢两种元素 B. 该化合物中碳、氢原子个数比为1:4
C. 无法确定该化合物是否含有氧元素 D. 该化合物一定是C2H8O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同物质的量的下列有机物,充分燃烧,消耗氧气的量相同的是
A. C3H4和C2H6B. C3H6和C3H8O
C. C3H6O2和C3H8OD. C3H8O和C4H8O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4是两种重要的温室气体,通过CH4和CO2的反应,制造更高价值的化学品是目前的研究目标。250℃时,以镍合金为催化剂,发生如下反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
(1)此温度下该反应的平衡常数表达式K=___;
(2)已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(g) △H=-890.3kJmol-1
②CO(g)+H2O(g)═CO2(g)+H2(g) △H=+2.8kJmol-1
③2CO(g)+O2(g)═2CO2(g) △H=-566.0kJmol-1
反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)的△H=___kJmol-1。
2CO(g)+2H2(g)的△H=___kJmol-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com