
【题目】向1.00L0.3mol/L的NaOH溶液中缓慢通入CO2气体至溶液增重8.8g,所得溶液中( )
A.溶质为Na2CO3
B.溶质为Na2CO3、NaHCO3
C.![]() c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
D.c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H+)
【答案】BD
【解析】
向1L0.3mol/L的NaOH溶液中缓缓通入CO2气体至溶液增重8.8g,则增重的8.8g为二氧化碳的质量,物质的量为0.2mol,发生反应CO2+NaOH=NaHCO3,CO2+2NaOH=Na2CO3+H2O,由于n(CO2):n(NaOH)=2:3=1:1.5,介于1:1~1:2之间,所以两个反应都发生,所得溶液中溶质为Na2CO3和NaHCO3,结合物料守恒与电荷守恒判断。
A.由上述分析可知,溶液为Na2CO3和NaHCO3,故A错误;
B.由上述分析可知,溶液为Na2CO3和NaHCO3,故B正确;
C.由碳元素守恒可知c(HCO3-)+c(CO32-)+c(H2CO3)=0.2mol/L,溶液中c(Na+)=0.3mol/L,所以![]() c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),故C错误;
c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),故C错误;
D.根据溶液电荷守恒c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),所以c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H+),故D正确。
故选:BD。


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:
【题目】卤代烃在工农业生产及人们的生活中具有广泛的用途,可用作灭火剂(如四氯化碳)、冷冻剂(如氟利昂)、麻醉剂(如氯仿,现已不使用),以及高分子工业的原料(如氯乙烯、四氟乙烯)等。卤代烃化学性质比较活泼,能发生取代反应、消去反应等,从而转化成其他类型的化合物,在有机合成中起着重要的桥梁作用。已知下面三个反应(其中A为氯代烃,B为烯烃)
反应① A![]() B
B
反应② B![]() CH3COOH+CO2↑+H2O
CH3COOH+CO2↑+H2O
反应③ CH3CH2CH=CH2+HBr![]() CH3CH2CH2CH2Br
CH3CH2CH2CH2Br
(注: RCH=CH2![]() RCOOH+CO2↑+H2O)
RCOOH+CO2↑+H2O)
请回答下列问题:
(1)化合物B的分子式为____,1mol化合物B完全燃烧需要消耗标准状况下____L的氧气。
(2)由丙醇可以制备B,该反应的反应条件为________,反应类型为________。
(3)假设A在核磁共振氢谱中有两组峰,且峰面积之比为6:1,那么A在氢氧化钾水溶液中加热反应生成的有机化合物的结构简式为________。
(4)写出B在有机过氧化物(R—O—O—R)中与HBr反应的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 是四种短周期元素,它们的核电荷数依次增大,四种元素的性质或原子结构的部分信息如表所示。
是四种短周期元素,它们的核电荷数依次增大,四种元素的性质或原子结构的部分信息如表所示。
元素 | 元素性质或原子结构的部分信息 |
| 元素的离子核外无电子 |
| 地壳中含量最多的元素 |
| 元素的离子半径在该周期中最小 |
|
|
下列叙述不正确的是( )
A.![]() 与
与![]() 形成的化合物在常温下为气体
形成的化合物在常温下为气体
B.![]() 的最高价氧化物对应的水化物不与
的最高价氧化物对应的水化物不与![]() 溶液反应
溶液反应
C.![]() 和
和![]() 形成的常见化合物能形成酸雨
形成的常见化合物能形成酸雨
D.简单氢化物的稳定性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式及有关应用的叙述中,正确的是( )
A.甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH=890.3 kJ/mol
B.取50mL 0.55mol/L NaOH(aq)和50mL 0.50mol/L HCl(aq)进行中和热的测定实验,用温度计测定HCl(aq)起始温度后,直接测定NaOH(aq)的温度,会使中和热ΔH偏小
C.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g)![]() 2NH3(g) △H = -38.6kJmol-1
2NH3(g) △H = -38.6kJmol-1
D.已知25℃、101KPa条件下:4Al(s) + 3O2(g) ═ 2A12O3(s) △H = -2834.9kJmol-1,4Al(s) + 2O3(g) ═ 2A12O3(s) △H = -3119.1kJmol-1,则O2比O3稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表回答下列问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ |
(1)写出下列元素符号:①______,⑥______,⑦______,⑨______。
(2)在这些元素中,最活泼的金属元素是______(填元素符号,下同),最活泼的非金属元素是______,最不活泼的元素是______。
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的是__________________,碱性最强的是__________________,呈两性的氢氧化物是__________________;三者之间相互反应的化学方程式是____________________________________。
(4)在这些元素(稀有气体元素除外)中,原子半径最小的是__________,原子半径最大的是____。
(5)在③与④中,化学性质较活泼的是__________,怎样用化学实验证明?______________ 在⑧与中,化学性质较活泼的是______,怎样用化学实验证明?________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是一种二元弱酸,在菠菜、苋菜、甜菜等植物中含量较高。25℃时,向H2C2O4溶液中滴加NaOH溶液,混合溶液中lgX [X表示 ![]() 或
或![]() 随pH的变化关系如图所示。下列说法不正确的是 ( )
随pH的变化关系如图所示。下列说法不正确的是 ( )
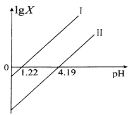
A.直线I中X表示的是![]()
B.直线I、Ⅱ的斜率均为1
C.0.1mol/ L NaHC2O4溶液中:c(Na+)>c(HC2O4-)> c(C2O42-)> c(H2C2O4)
D.已知:25℃时,NH3·H2O的电离常数为10-4.69,则(NH4)2C2O4溶液呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸盐(如ZnS2O4)在工业中用作漂白剂、解毒剂、吸氧剂等,用途十分广泛。
Ⅰ.制取ZnS2O4溶液和晶体
控制3545℃进行反应,原理为:Zn+2SO2=ZnS2O4。
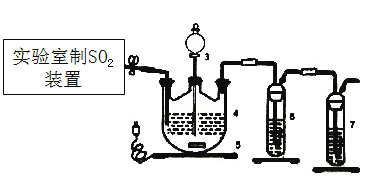
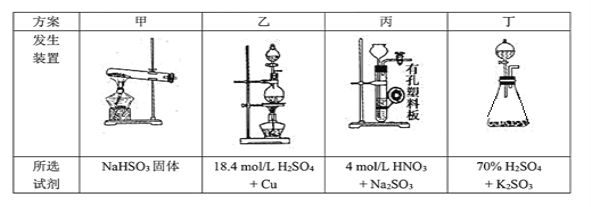
(1)下列四种制备SO2的方案中最佳选择是___________。
(2)停止电加热,仪器3放入一定量乙醇,制得ZnS2O4晶体,主要原因是_________。
Ⅱ.测定产率
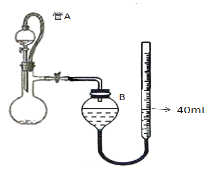
(3)仪器4中加入mg锌粉与一定量的水,电加热并启动磁力搅拌器5。一段时间后,待固体物质完全消失时,关闭活塞和止水夹。取ZnS2O4晶体的十分之一放于真空容器中,加适量的水、通适量氧气使其恰好转化为Zn(HSO4)2和Zn(HSO3)2固体,然后加入足量的硫酸,通过测定生成气体的体积来求算ZnS2O4晶体的产率。请回答下列相关问题:
①测定装置中,导管A的作用:一是________;二是________。
②为提高测定的准确度,仪器B中最宜选用_____________。
A.饱和食盐水 B.饱和NaHSO3溶液 C. 饱和澄清石灰水 D.98.3%的浓硫酸
③用图中量气管读数为起点,若终点读数为17.60mL,且实验温度下气体摩尔体积为VmL.mol-1,可得出ZnS2O4的产率为 ____________%。
(4)如果反应温度超过45℃,会导致ZnS2O4分解,仪器4中有黄色沉淀、白色沉淀且伴随着气泡生成,则ZnS2O4分解的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,水溶液中-lg c(H+)与-lg c(OH)。关系如图所示。下列说法不正确的是( )
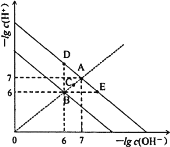
A.图中五点Kw间的关系:B>C>A=D=E
B.A→E点对应的水溶液中,可能有NH4+、Ba2+、Cl、I大量同时存在
C.若0.1mol·L1的NaHA溶液水溶液中c(H+)与c(OH)关系如图D点所示,则溶液中有:c(HA)>c(OH)>c(A2)>c(H2A)
D.向NaHSO4溶液中滴入Ba(OH)2溶液,当c(H+)与c(OH)关系如图E点所示,则溶液中反应:2H++SO42-+Ba2++2OH=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芜湖市某便利店销售的一种食用碘盐包装袋上有如下标签:
产品标准 | GB5461 |
产品等级 | 一级 |
配料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,请配平化学方程式:____KIO3+____KI+____H2SO4=____K2SO4+_____I2+____H2O
(2)实验室可分离获取单质碘,其实验操作可分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把适量碘水和CCl4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口玻璃塞是否漏液;
D.倒转漏斗,用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收下层溶液;
F.从分液漏斗的上口倒出上层水溶液;
G.将漏斗上口的玻璃塞打开;
H.静置、分层;
①正确的操作顺序是(用编号字母填写)____→____ → ___→A → __→ ___→E→F。
②下列物质,不能作为从水溶液中萃取碘的溶剂是____。
A.苯 B.汽油 C.酒精
(3)若向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。理论上Na2SO3与I2反应的物质的量之比为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com