
【题目】在100mL0.5mol/L的NaOH溶液中通入一定量的CO2,测得反应后的溶液中CO32-和HCO3-的物质的量浓度之比为1∶3,则通入的CO2气体在标准状况下的体积是________________mL。
【答案】896mL
【解析】
NaOH溶液中通入一定量的CO2,测得反应后的溶液中![]() 和
和![]() 的物质的量浓度之比为1:3,说明NaOH、CO2都完全反应,溶液中溶质为Na2CO3、NaHCO3,令通入CO2的物质的量为ymol,表示出Na2CO3、NaHCO3的物质的量,再根据钠离子列方程计算,根据V=nVm计算CO2的体积。
的物质的量浓度之比为1:3,说明NaOH、CO2都完全反应,溶液中溶质为Na2CO3、NaHCO3,令通入CO2的物质的量为ymol,表示出Na2CO3、NaHCO3的物质的量,再根据钠离子列方程计算,根据V=nVm计算CO2的体积。
令通入CO2的物质的量为ymol,则Na2CO3为0.25ymol,NaHCO3为0.75ymol,根据钠离子守恒,可得:0.25ymol×2+0.75y mol=0.1L×0.5mol/L,解得y=0.04mol,
故通入CO2的体积=0.04mol×22.4L/mol=0.896L=896mL。


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】我国科研人员采用新型锰催化体系,选择性实现了简单酮与亚胺的芳环惰性C-H的活化反应。利用该反应制备化合物J的合成路线如下:

已知:
回答下列问题:
(1)A中官能团的名称是______。F的化学名称是______。
(2)C和D生成E的化学方程式为_____________。
(3)G的结构简式为________。
(4)由D生成F,E和H生成J的反应类型分别是______、_____。
(5)芳香化合物K是E的同分异构体。若K能发生银镜反应,则K可能的结构有____种,其中核磁共振氢谱有四组峰的结构简式为______(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式及有关应用的叙述中,正确的是( )
A.甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH=890.3 kJ/mol
B.取50mL 0.55mol/L NaOH(aq)和50mL 0.50mol/L HCl(aq)进行中和热的测定实验,用温度计测定HCl(aq)起始温度后,直接测定NaOH(aq)的温度,会使中和热ΔH偏小
C.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g)![]() 2NH3(g) △H = -38.6kJmol-1
2NH3(g) △H = -38.6kJmol-1
D.已知25℃、101KPa条件下:4Al(s) + 3O2(g) ═ 2A12O3(s) △H = -2834.9kJmol-1,4Al(s) + 2O3(g) ═ 2A12O3(s) △H = -3119.1kJmol-1,则O2比O3稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是一种二元弱酸,在菠菜、苋菜、甜菜等植物中含量较高。25℃时,向H2C2O4溶液中滴加NaOH溶液,混合溶液中lgX [X表示 ![]() 或
或![]() 随pH的变化关系如图所示。下列说法不正确的是 ( )
随pH的变化关系如图所示。下列说法不正确的是 ( )
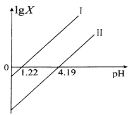
A.直线I中X表示的是![]()
B.直线I、Ⅱ的斜率均为1
C.0.1mol/ L NaHC2O4溶液中:c(Na+)>c(HC2O4-)> c(C2O42-)> c(H2C2O4)
D.已知:25℃时,NH3·H2O的电离常数为10-4.69,则(NH4)2C2O4溶液呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸盐(如ZnS2O4)在工业中用作漂白剂、解毒剂、吸氧剂等,用途十分广泛。
Ⅰ.制取ZnS2O4溶液和晶体
控制3545℃进行反应,原理为:Zn+2SO2=ZnS2O4。
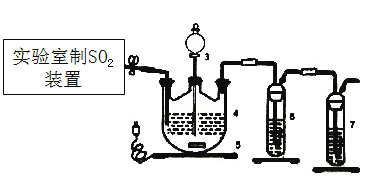
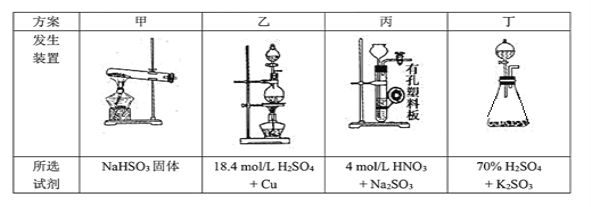
(1)下列四种制备SO2的方案中最佳选择是___________。
(2)停止电加热,仪器3放入一定量乙醇,制得ZnS2O4晶体,主要原因是_________。
Ⅱ.测定产率
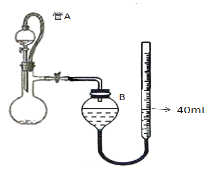
(3)仪器4中加入mg锌粉与一定量的水,电加热并启动磁力搅拌器5。一段时间后,待固体物质完全消失时,关闭活塞和止水夹。取ZnS2O4晶体的十分之一放于真空容器中,加适量的水、通适量氧气使其恰好转化为Zn(HSO4)2和Zn(HSO3)2固体,然后加入足量的硫酸,通过测定生成气体的体积来求算ZnS2O4晶体的产率。请回答下列相关问题:
①测定装置中,导管A的作用:一是________;二是________。
②为提高测定的准确度,仪器B中最宜选用_____________。
A.饱和食盐水 B.饱和NaHSO3溶液 C. 饱和澄清石灰水 D.98.3%的浓硫酸
③用图中量气管读数为起点,若终点读数为17.60mL,且实验温度下气体摩尔体积为VmL.mol-1,可得出ZnS2O4的产率为 ____________%。
(4)如果反应温度超过45℃,会导致ZnS2O4分解,仪器4中有黄色沉淀、白色沉淀且伴随着气泡生成,则ZnS2O4分解的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2(g) + B2(g)=2AB(g) 的能量变化如图所示,下列叙述中正确的是( )
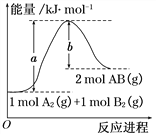
A.每生成2mol AB(g) 共吸收b kJ热量
B.该反应热ΔH = +(a-b) kJ·mol-1
C.反应物的总能量大于生成物的总能量
D.断裂1 mol A—A键,放出a kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,水溶液中-lg c(H+)与-lg c(OH)。关系如图所示。下列说法不正确的是( )
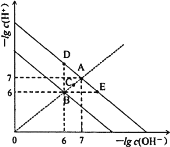
A.图中五点Kw间的关系:B>C>A=D=E
B.A→E点对应的水溶液中,可能有NH4+、Ba2+、Cl、I大量同时存在
C.若0.1mol·L1的NaHA溶液水溶液中c(H+)与c(OH)关系如图D点所示,则溶液中有:c(HA)>c(OH)>c(A2)>c(H2A)
D.向NaHSO4溶液中滴入Ba(OH)2溶液,当c(H+)与c(OH)关系如图E点所示,则溶液中反应:2H++SO42-+Ba2++2OH=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组研究大小相同、过量的去膜镁条与40mL0.1mol·L1的盐酸和醋酸分别反应,相同条件下测得气体体积与反应时间关系如下表所示:
气体读数/mL | 5 mL | 10 mL | 15 mL | 20 mL | …… | 45 mL |
A瓶(醋酸)/s | 155 | 310 | 465 | 565 | …… | 865 |
B瓶(盐酸)/s | 7 | 16 | 30 | 64 | …… | 464 |
下列说法不正确的是( )
A.0~5mL时,A与B反应速率不同的原因是c(H+)不同所致
B.5~10mL时,A瓶平均反应速率为![]() mL·s1
mL·s1
C.0~20mL时,A瓶反应速率增大,可能是温度升高所致
D.0~45mL时段内,镁与盐酸反应的速率始终大于镁与醋酸反应的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究有机物A 的组成与结构,某同学进行如下实验。
i.0.2 molA 在氧气中完全燃烧后,生成CO2 和H2O 各 0.6 mol。
ii.通过质谱法测得其相对分子质量为 90。
iii.通过红外光谱法测得A 中含有—OH 和—COOH。
iv.A 的核磁共振氢谱图显示四组峰,峰面积之比为 1:1:1:3。
请回答下列问题。
(1)A 的分子式是_____。
(2)A 的结构简式是_____。
(3)已知:RCH2CH2OH![]() RCH=CH2 + H2O,在一定条件下,A有如下转化关系:A
RCH=CH2 + H2O,在一定条件下,A有如下转化关系:A![]() B
B![]() C其中,C是高分子物质,则A转化为B的化学方程式是:_____。C 的结构简式是:_____。
C其中,C是高分子物质,则A转化为B的化学方程式是:_____。C 的结构简式是:_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com