
【题目】我国科研人员采用新型锰催化体系,选择性实现了简单酮与亚胺的芳环惰性C-H的活化反应。利用该反应制备化合物J的合成路线如下:

已知:
回答下列问题:
(1)A中官能团的名称是______。F的化学名称是______。
(2)C和D生成E的化学方程式为_____________。
(3)G的结构简式为________。
(4)由D生成F,E和H生成J的反应类型分别是______、_____。
(5)芳香化合物K是E的同分异构体。若K能发生银镜反应,则K可能的结构有____种,其中核磁共振氢谱有四组峰的结构简式为______(任写一种)。
【答案】醛基 4-硝基甲苯(对硝基甲苯) 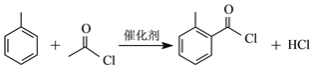
![]() 取代反应 加成反应 14
取代反应 加成反应 14 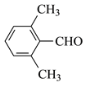 或
或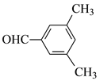
【解析】
A(C2H4O)能够与新制氢氧化铜反应,说明A含有醛基,因此A为CH3CHO,则B为CH3COOH;结合C和E的分子式可知,C和D应该发生取代反应生成E和氯化氢,则D为![]() ;甲苯在浓硫酸作用下发生硝化反应生成F,结合J的结构可知,F为对硝基甲苯(
;甲苯在浓硫酸作用下发生硝化反应生成F,结合J的结构可知,F为对硝基甲苯(![]() ),F被还原生成G,G为对氨基甲苯(
),F被还原生成G,G为对氨基甲苯(![]() ),根据已知信息,G和乙醛反应生成H,结合J的结构可知,H为
),根据已知信息,G和乙醛反应生成H,结合J的结构可知,H为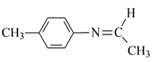 ,则E为
,则E为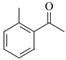 ,据此分析解答。
,据此分析解答。
(1)根据上述分析,A为C2H4O,含有的官能团为醛基;F为![]() ,名称为对硝基甲苯,故答案为:醛基;4-硝基甲苯(对硝基甲苯);
,名称为对硝基甲苯,故答案为:醛基;4-硝基甲苯(对硝基甲苯);
(2)C和D发生取代反应生成E,反应的化学方程式为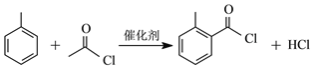 ,故答案为:
,故答案为: ;
;
(3)G为对硝基甲苯中硝基被还原的产物,G为![]() ,故答案为:
,故答案为:![]() ;
;
(4)由D生成F是甲苯的硝化反应,属于取代反应,根据流程图,E和H生成J的过程中N=C双键转化为了单键,属于加成反应,故答案为:取代反应;加成反应;
(5)E为 ,芳香化合物K是E的同分异构体。若K能发生银镜反应,说明K中含有醛基,则K的结构有:苯环上连接1个乙基和1个醛基有3种;苯环上连接2个甲基和1个醛基有6种;苯环上连接1个甲基和1个—CH2CHO有3种;苯环上连接1个—CH2 CH2CHO有1种;苯环上连接1个—CH(CH3)CHO有1种,共14种;其中核磁共振氢谱有四组峰的结构简式为
,芳香化合物K是E的同分异构体。若K能发生银镜反应,说明K中含有醛基,则K的结构有:苯环上连接1个乙基和1个醛基有3种;苯环上连接2个甲基和1个醛基有6种;苯环上连接1个甲基和1个—CH2CHO有3种;苯环上连接1个—CH2 CH2CHO有1种;苯环上连接1个—CH(CH3)CHO有1种,共14种;其中核磁共振氢谱有四组峰的结构简式为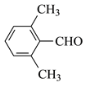 或
或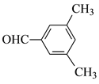 ,故答案为:14;
,故答案为:14; 或
或 。
。


科目:高中化学 来源: 题型:
【题目】氮氧化合物是工业生产重要原料,也是大气污染的重要来源,研究氮氧化合物相关反应原理具有重要意义。回答下列问题:
(1)一步完成的反应称为基元反应,只由基元反应构成的化学反应称为简单反应,两个及以上基元反应构成的化学反应称为复杂反应,复杂反应的速率取决(等)于慢的基元反应速率。基元反应aA+bB=cC+dD的速率方程为v=k·ca(A)·cb(B),其中k为速率常数。已知反应NO2+CO=NO+CO2 ,在不同温度下反应机理不同。
①温度高于490K时,上述反应为简单反应,请写出其速率方程______________。
②温度高于520K时,该反应是由两个基元反应构成的复杂反应,其速率方程v=k·c2(NO2),已知慢的基元反应的反应物和产物为NO、NO2 、NO3,用方程式表示反应历程。
第一步:____________________(慢反应)。
第二步:____________________(快反应)。
(2)N2O4(g) ![]() 2NO2(g) ΔH =+57 kJ·mol-1 该反应是高中和大学化学学习的经典素材。
2NO2(g) ΔH =+57 kJ·mol-1 该反应是高中和大学化学学习的经典素材。
①对于上述反应下列说法不正确的一项是_________(填字母)。
A.恒温恒容,加入N2O4重新达到平衡体系颜色加深
B.恒温恒容,加入NO2重新达到平衡NO2体积分数变大
C.绝热容器中,体系颜色不变,说明该反应处于平衡状态
D. 恒温恒压下,加入N2O4重新达到平衡体系颜色不变
②T1K时,向1L真空容器中加入1molN2O4 ,达到平衡时NO2的平衡产率为20%,则该温度下的平衡常数K=____,达到平衡时吸收的热量为_____kJ。某温度下,该反应达到平衡,NO2与N2O4的混合气体总压强为100KPa,密度为同状态下氢气密度的34.5倍,平衡常数KP=____KPa(用平衡分压代替平衡浓度计算)。
③若v(N2O4)=k1·c(N2O4) v(NO2)=k2·c(NO2),T2温度下,若k1=k2 ,则T2____T1(填“高于”或“低于”)。
(3)复杂反应2NO(g)+O2(g)=2NO2(g)由两个基元反应构成,2NO(g)=N2O2(g) (快速平衡)N2O2(g) +O2(g)=2NO2(g)(慢反应),已知快反应为放热反应,其正、逆反应速率常数分别为k1和k2慢反应正、逆反应速率常数分别为k3和k4。若v正=k·c2(NO)·c(O2) 则k=______(用k1、k2、k3表示);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应H2(g)+I2(g)![]() 2HI(g)
2HI(g) ![]() H<0,下列说法正确的是
H<0,下列说法正确的是
A. 反应达到平衡后,缩小容器体积,混合气体平均相对分子质量变小
B. 反应达到平衡后,保持容器温度和体积不变,充入HI气体,再次达到平衡,H2转化率减小,平衡常数K值减小
C. 若v正(H2)=2v逆(HI),反应达到平衡状态
D. 反应达到平衡后,保持容器体积不变,升温,反应体系的颜色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在我国南海、东海海底均存在大量的可燃冰(天然气水合物,可表示为![]() )。
)。
2017年5月,中国首次海域可燃冰试采成功。2017年11月3日,国务院正式批准将可燃冰列为新矿种。可燃冰的开采和利用,既有助于解决人类面临的能源危机,又能生成一系列的工业产品。
(1)对某可燃冰矿样进行定量分析,取一定量样品,释放出的甲烷气体体积折合成标准状况后为166 m3,剩余 H2O 的体积为0.8m3,则该样品的化学式中 x=_________________。
(2)已知下表数据,且知 H2O(l)=H2O(g) △H=+41![]()
化学键 | C—H | O=O | C=O | H—O |
键能/ | 413 | 498 | 803 | 463 |
用甲烷燃烧热表示的热化学方程式为_____________________________________________________。
(3)甲烷燃料电池相较于直接燃烧甲烷有着更高的能量转化效率,某甲烷燃料电池,正极通入空气,以某种金属氧化物为离子导体(金属离子空穴中能传导 O2-),该电池负极的电极反应式为__________________________________________。
(4)甲烷与水蒸气重整制氢是工业上获得氢气的重要手段。若甲烷与脱盐水在一定条件下反应生成H2,同时得到体积比为1:3的CO2和CO,该反应的化学方程式为_____________________________________。混合气体中的CO2可用浓氨水脱除,同时获得氮肥NH4HCO3,该反应的离子方程式是_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A.金刚石、B.MgF2、C.NH4Cl、D.NaNO3、E.干冰、F.固体碘,填写下列空白。(用序号填写)
(1)熔化时不需破坏化学键的是________,熔化时只需破坏共价键的是________,熔点最低的是________,
晶体中既存在离子键又存在共价键的是________。
(2)意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1 mol N—N键吸收167 kJ热量,生成1 mol N≡N键放出942 kJ热量。根据以上信息和数据,则1 mol N4生成N2的ΔH=______ kJ·mol-1

(3) 50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的NaOH溶液在如图所示的装置中进行中和反应。

请回答下列问题:
从实验装置上看,图中尚缺少的一种玻璃仪器是_____,烧杯间填满碎泡沫塑料的作用是______。大烧杯上如不盖硬纸板,则求得的中和热数值_______(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示2套实验装置,分别回答下列问题。

(1)装置1为铁的吸氧腐蚀实验。一段时间后,取玻璃筒内的溶液滴入铁氰化钾溶液,可观察到蓝色沉淀,表明铁被__________(填“氧化“或“还原”);向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为______________________。
(2)装置2中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红。
①电源的M端为__________极;甲烧杯中Cu电极的电极反应为__________。
②乙烧杯中电解反应的离子方程式为______________________________。
③取出乙溶液中Cu电极,洗涤、干燥、称量、电极增重0.64 g,甲烧杯中石墨电极产生的气体标准状况下体积为__________mL。若想使乙烧杯中电解质溶液复原,可以加入的物质是:__________(填字母)。(Cu的原子量为64)
A. CuO B. Cu(OH)2 C. Cu2(OH)2CO3 D. CuCO3 E. CuSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是重要的化工原料,发展前景广阔。
(1)利用甲醇可制成微生物燃料电池(利用微生物将化学能直接转化成电能的装置)。某微生物燃料电池装置如下图所示:

A极附近的电极反应式是_________。
(2)研究表明CO2加氢可以合成甲醇。反应如下:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
①反应的化学平衡常数表达式K=_________。
②有利于提高反应中CO2的平衡转化率的措施有_________(填序号)。
a. 使用催化剂 b. 加压 c. 增大CO2和H2的初始投料比![]()
③研究温度对于甲醇产率的影响。在210℃~290℃,保持原料气中CO2和H2的投料比不变,按一定流速通过催化剂,得到甲醇的平衡产率与温度的关系如下图所示。该反应焓变![]() H_________0(填“>”、“=”或“<”),其依据是________。
H_________0(填“>”、“=”或“<”),其依据是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状态下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H、H—O和O===O键的键焓ΔH分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1。下列热化学方程式正确的是
A. H2O(g)===H2+1/2O2(g)ΔH=-485 kJ·mol-1
B. H2O(g)===H2(g)+1/2O2(g) ΔH=+485 kJ·mol-1
C. 2H2(g)+O2(g)===2H2O(g) ΔH=+485 kJ·mol-1
D. 2H2(g)+O2(g)===2H2O(g) ΔH=-485 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:25 ℃、101 kPa时,Mn(s)+O2(g)===MnO2(s) ΔH=-520 kJ·mol-1;S(s)+O2(g)===SO2(g) ΔH=-297 kJ·mol-1;Mn(s)+S(s)+2O2(g)===MnSO4(s) ΔH=-1 065 kJ·mol-1 SO2与MnO2反应生成无水MnSO4的热化学方程式是___________________________。
(2)已知:温度过高时,WO2(s)转变为WO2(g):①WO2(s)+2H2(g)![]() W(s)+2H2O(g) ΔH=+66.0 kJ·mol-1②WO2(g)+2H2(g)
W(s)+2H2O(g) ΔH=+66.0 kJ·mol-1②WO2(g)+2H2(g)![]() W(s)+2H2O(g) ΔH=-137.9 kJ·mol-1;则WO2(s)W
W(s)+2H2O(g) ΔH=-137.9 kJ·mol-1;则WO2(s)W![]() O2(g)的ΔH=______________
O2(g)的ΔH=______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com