
【题目】如图所示2套实验装置,分别回答下列问题。

(1)装置1为铁的吸氧腐蚀实验。一段时间后,取玻璃筒内的溶液滴入铁氰化钾溶液,可观察到蓝色沉淀,表明铁被__________(填“氧化“或“还原”);向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为______________________。
(2)装置2中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红。
①电源的M端为__________极;甲烧杯中Cu电极的电极反应为__________。
②乙烧杯中电解反应的离子方程式为______________________________。
③取出乙溶液中Cu电极,洗涤、干燥、称量、电极增重0.64 g,甲烧杯中石墨电极产生的气体标准状况下体积为__________mL。若想使乙烧杯中电解质溶液复原,可以加入的物质是:__________(填字母)。(Cu的原子量为64)
A. CuO B. Cu(OH)2 C. Cu2(OH)2CO3 D. CuCO3 E. CuSO4
【答案】氧化 O2+4e-+2H2O==4OH- 正 Cu-2e-==Cu2+ 2Cu2++2H2O![]() 2Cu+O2↑+4H+ 224 AD
2Cu+O2↑+4H+ 224 AD
【解析】
(1)装置1为铁的吸氧腐蚀实验,发生电化学腐蚀,铁钉附近的溶液有蓝色沉淀,表明铁被氧化,铁为负极,电极反应式为O2+4e-+2H2O═4OH-;
(2)①M端为正极,N端为负极,阴极反应为Cu-2e-═Cu2+;
②电解的离子方程式为2Cu2++2H2O![]() 2Cu+O2↑+4H+;
2Cu+O2↑+4H+;
③根据电极反应和电极上转移电子的数目相等进行计算。
(1)装置1为铁的吸氧腐蚀实验,发生电化学腐蚀,铁钉附近的溶液有蓝色沉淀,表明铁被氧化,铁为负极,碳为正极,观察到碳棒附近的溶液变红,说明在碳极上氧气得电子生成OH-离子,反应的电极反应式为O2+4e-+2H2O═4OH-,故答案为:氧化,O2+4e-+2H2O═4OH-。
(2)①反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,说明在石墨电极上生成OH-离子,电极反应为:2H2O+2e-═2OH-+H2↑,发生还原反应,为电解池的阴极,连接电源的负极,即M端为正极,N端为负极,阴极反应为Cu-2e-═Cu2+,故答案为:正;Cu-2e-═Cu2+。
②乙烧杯电解硫酸铜溶液,石墨为阳极,电极反应为4OH--4e-═O2↑+H2O,Cu为阴极,电极反应为Cu2++2e-═Cu,电解的总反应为2Cu2++2H2O![]() 2Cu+O2↑+4H+,
2Cu+O2↑+4H+,
故答案为:2Cu2++2H2O![]() 2Cu+O2↑+4H+;
2Cu+O2↑+4H+;
③取出Cu电极,洗涤、干燥、称量、电极增重0.64g,则生成Cu的物质的量为0.64g/64g/mol=0.01mol,转移的电子的物质的量为0.01mol×2=0.02mol,根据甲烧杯产生气体的电极反应计算生成气体的体积,
2H2O+2e-═2OH-+H2↑,
2mol 22.4L
0.02mol V
V=22.4L×0.02mol/2mol=0.224L,即224ml。
由电解总反应方程式为2CuSO4+2H2O![]() 2Cu+O2↑+4H2SO4,根据析出什么加入什么的原则,则应往溶液中加入CuO或CuCO3,故AD正确。
2Cu+O2↑+4H2SO4,根据析出什么加入什么的原则,则应往溶液中加入CuO或CuCO3,故AD正确。
故答案为:224,AD。


科目:高中化学 来源: 题型:
【题目】实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
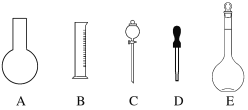
(1)①如图所示的仪器中配制溶液肯定不需要的是____________________(填字母),
②配制上述溶液还需用到的玻璃仪器是__________________(填仪器名称)。
③下列有关容量瓶使用说法不正确的是( )
a.容量瓶使用前一定要检查是否漏液。其操作为装水盖上瓶塞→倒立观察是否漏夜→正立→玻璃塞旋转180°→再倒立观察是否漏夜。
b.不能作为反应容器或长期贮存溶液的容器;但是可以配制任意体积的溶液。
c.不能将固体或浓溶液直接在容量瓶中溶解或稀释;不能加入过冷或过热的液体 。
d.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小。
(2)在配制NaOH溶液时:
①根据计算用托盘天平称取NaOH的质量为________g;
②若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度___________(填“>”、“<”或“=”)0.1 mol·L-1;
③若NaOH固体溶解后立即移入容量瓶→洗涤烧杯和玻璃棒→洗涤液移入容量瓶→定容,则所得溶液浓度___________(填“>”、“<”或“=”) 0.1 mol·L-1。
(3)在配制硫酸溶液时:
①所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为__________(计算结果保留一位小数)mL;
②如果实验室有15 mL、50 mL、100 mL量筒,应选用___________mL量筒最好;
③配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质为易溶于水的白色粉末,在工业循环水中可用作杀菌剂,也可用作钙、镁离子的络合剂,其结构可用下图表示。已知四种常见元素X、Y、Z、W原子序数依次增大,且分别位于不同周期,下列说法错误的是( )

A.Z元素在该物质中为+3价
B.W的简单阳离子比Z的简单阴离子多一个电子层
C.W的最高价氧化物的水化物的水溶液可与Al粉发生反应
D.Z单质与Y单质反应可产生Z2Y5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前我国主要采用硫酸法生产钛白(TiO2),每年产生至少100万吨钛白废液,其中含H2SO4约20%,还有少量Fe2+、TiO2+、Al3+。利用钛白废液浸出氧化锌生产七水硫酸锌,具有原料易得、工艺简单、回收率高和产品纯度高等优点。生产流程简化如下:

回答下列问题:
(1)“浸出”时发生的主要反应的离子方程式为_______。
(2)为寻找“浸出”的最佳条件,做9组对比实验得下表:
因素 | 温度/℃ | 反应时间/h | 固液比 | 产率/% |
1 | 70 | 2 | 1∶6.5 | 79.83 |
2 | 70 | 3 | 1∶7.5 | 86.18 |
3 | 70 | 4 | 1∶8.5 | 84.33 |
4 | 80 | 2 | 1∶7.5 | 83.06 |
5 | 80 | 3 | 1∶8.5 | 87.02 |
6 | 80 | 4 | 1∶6.5 | 95.38 |
7 | 90 | 2 | 1∶8.5 | 83.58 |
8 | 90 | 3 | 1∶6.5 | 88.95 |
9 | 90 | 4 | 1∶7.5 | 89.64 |
由表中数据可知,“浸出率”最高时的反应条件是_______。
(3)从生产实际考虑,调滤液的pH时选择加入石灰乳的原因是_______。
(4)常温下,按1:6固液质量比反应的浸出液中锌离子浓度最大值约为2.5mol/L,若Ksp[Zn(OH)2]=1.2×10-17,lg4.8≈0.68。则加入石灰乳调节的pH应不超过______(保留一位小数)。
(5)在加热下鼔入空气时,发生反应的化学方程式是___,此时TiO2+也会水解生成H2TiO3沉淀,发生反应的离子方程式为_____。
(6)加热下加入H2O2目的是进一步氧化除杂,氧化产物为__。抽滤得到的滤渣主要成分有___和H2TiO3(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员采用新型锰催化体系,选择性实现了简单酮与亚胺的芳环惰性C-H的活化反应。利用该反应制备化合物J的合成路线如下:

已知:
回答下列问题:
(1)A中官能团的名称是______。F的化学名称是______。
(2)C和D生成E的化学方程式为_____________。
(3)G的结构简式为________。
(4)由D生成F,E和H生成J的反应类型分别是______、_____。
(5)芳香化合物K是E的同分异构体。若K能发生银镜反应,则K可能的结构有____种,其中核磁共振氢谱有四组峰的结构简式为______(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向0.1mol·L-1NaA溶液中逐滴滴加盐酸,测得混合溶液的pH与p![]() 变化关系如图所示[
变化关系如图所示[![]() =-lg
=-lg![]() ]。下列说法正确的是
]。下列说法正确的是

A. a点溶液中c(Na+)=c(A-)
B. 电离常数K(HA)的数量级为10-4
C. 滴加过程中![]() 不断减小
不断减小
D. b点溶液中c(HA)>c(Na+)>c(A-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用酸解法制钛白粉产生的废液[含有大量的FeSO4、H2SO4和少量的Fe2(SO4)3、TiOSO4]生产铁红和补血剂乳酸亚铁的工艺流程如图所示:

已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-,TiO2+水解成TiO2·xH2O沉淀为可逆反应;乳酸结构简式为CH3CH(OH)COOH。
回答下列问题:
(1)TiOSO4中钛元素的化合价是____________,步骤①中分离硫酸亚铁溶液和滤渣的操作是___________。
(2)滤渣的主要成分为TiO2·xH2O,结合离子方程式解释得到滤渣的原因:________。
(3)从硫酸亚铁溶液中得到硫酸亚铁晶体的操作方法是____________________;硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应的氧化剂和还原剂的物质的量之比为______。
(4)步骤④中发生反应的离子方程式为______________________。
(5)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及____________________。
(6)实验室中检验溶液B中主要阳离子的方法是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为__________,该元素的符号是__________;
 (2)Y元素原子的价层电子的轨道表示式为________,该元素的名称是__________;
(2)Y元素原子的价层电子的轨道表示式为________,该元素的名称是__________;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为____________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是_________________________________________________;
(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性、沸点高低并说明理由____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁晶体{[CH3CH(OH)COO]2Fe·3H2O,相对分子质量为288}易溶于水,是一种很好的补铁剂,可由乳酸[CH3 CH(OH)COOH]与FeCO3反应制得。
I.碳酸亚铁的制备(装置如下图所示)

(1)仪器B的名称是____;实验操作如下:打开kl、k2,加入适量稀硫酸,关闭kl,使反应进行一段时间,其目的是____。
(2)接下来要使仪器C中的制备反应发生,需要进行的操作是____,其反应的离子方程式为____。
(3)仪器C中混合物经过滤、洗涤得到FeCO3沉淀,检验其是否洗净的方法是____。
Ⅱ.乳酸亚铁的制各及铁元素含量测定
(4)向纯净FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应,经过滤,在____的条件下,经低温蒸发等操作后,获得乳酸亚铁晶体。
(5)两位同学分别用不同的方案进行铁元素含量测定:
①甲同学通过KMnO4滴定法测定样品中Fe2+的含量计算样品纯度。在操作均正确的前提下,所得纯度总是大于l00%,其原因可能是 ___。
②乙同学经查阅资料后改用碘量法测定铁元素的含量计算样品纯度。称取3.000g样品,灼烧完全灰化,加足量盐酸溶解,取所有可溶物配成l00mL溶液。吸取25.00 rnL该溶液加入过量KI溶液充分反应,然后加入几滴淀粉溶液,用0. 100 mol·L-1硫代硫酸钠溶液滴定(已知:I2+2S2O32-=S4O62-+2I-),当溶液____,即为滴定终点;平行滴定3次,硫代硫酸钠溶液的平均用量为24. 80 mL,则样品纯度为____%(保留1位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com