
【题目】目前我国主要采用硫酸法生产钛白(TiO2),每年产生至少100万吨钛白废液,其中含H2SO4约20%,还有少量Fe2+、TiO2+、Al3+。利用钛白废液浸出氧化锌生产七水硫酸锌,具有原料易得、工艺简单、回收率高和产品纯度高等优点。生产流程简化如下:

回答下列问题:
(1)“浸出”时发生的主要反应的离子方程式为_______。
(2)为寻找“浸出”的最佳条件,做9组对比实验得下表:
因素 | 温度/℃ | 反应时间/h | 固液比 | 产率/% |
1 | 70 | 2 | 1∶6.5 | 79.83 |
2 | 70 | 3 | 1∶7.5 | 86.18 |
3 | 70 | 4 | 1∶8.5 | 84.33 |
4 | 80 | 2 | 1∶7.5 | 83.06 |
5 | 80 | 3 | 1∶8.5 | 87.02 |
6 | 80 | 4 | 1∶6.5 | 95.38 |
7 | 90 | 2 | 1∶8.5 | 83.58 |
8 | 90 | 3 | 1∶6.5 | 88.95 |
9 | 90 | 4 | 1∶7.5 | 89.64 |
由表中数据可知,“浸出率”最高时的反应条件是_______。
(3)从生产实际考虑,调滤液的pH时选择加入石灰乳的原因是_______。
(4)常温下,按1:6固液质量比反应的浸出液中锌离子浓度最大值约为2.5mol/L,若Ksp[Zn(OH)2]=1.2×10-17,lg4.8≈0.68。则加入石灰乳调节的pH应不超过______(保留一位小数)。
(5)在加热下鼔入空气时,发生反应的化学方程式是___,此时TiO2+也会水解生成H2TiO3沉淀,发生反应的离子方程式为_____。
(6)加热下加入H2O2目的是进一步氧化除杂,氧化产物为__。抽滤得到的滤渣主要成分有___和H2TiO3(填化学式)。
【答案】ZnO+2H+==Zn2++H2O 80℃,反应时间4h,固液比1∶6.5 氢氧化钙价格低廉,并有较强的碱性 5.3 4Fe(OH)2+O2+2H2O==4Fe(OH)3 TiO2++2H2O ==H2TiO3↓+2H+ Fe(OH)3 CaSO4、Fe(OH)3、Al(OH)3
【解析】
钛白废液中含H2SO4约20%,还有少量Fe2+、TiO2+、Al3+。钛白废液中的酸与氧化锌反应,将氧化锌溶解,过滤除去不溶物,在滤液中加入石灰乳调节溶液的pH,可以使亚铁离子、铝离子沉淀,并使TiO2+水解生成沉淀,鼓入空气将氢氧化亚铁充分氧化转化为溶解度更小的氢氧化铁沉淀,混合液经过抽滤得到硫酸锌溶液,蒸发浓缩,冷却晶体得到硫酸锌晶体,据此分析解答。
(1)“浸出”时钛白废液中的酸与氧化锌反应,反应的离子方程式为ZnO+2H+=Zn2++H2O,故答案为:ZnO+2H+=Zn2++H2O;
(2)根据表格数据可知,温度在80℃,反应时间在4h左右,固液比为1∶6.5时,“浸出率”最高达95.38%,故答案为:80℃,反应时间4h,固液比1∶6.5;
(3)从生产实际考虑,工业生产一般都需要考虑成本,由于氢氧化钙价格低廉,并有较强的碱性因此调滤液的pH时选择加入石灰乳,故答案为:氢氧化钙价格低廉,并有较强的碱性;
(4)氢氧化锌刚好开始沉淀时,c(OH-)=![]() =
=![]() =4.8×10-8 mol/L,此时pH=14-[-lg(4.8×10-8)]≈14-(8+0.68) ≈ 5.3,为了除去溶液中的杂质离子,而不沉淀锌离子,溶液的pH应不超过5.3,故答案为:5.3;
=4.8×10-8 mol/L,此时pH=14-[-lg(4.8×10-8)]≈14-(8+0.68) ≈ 5.3,为了除去溶液中的杂质离子,而不沉淀锌离子,溶液的pH应不超过5.3,故答案为:5.3;
(5)在加热下鼔入空气时,生成的氢氧化亚铁被氧化生成氢氧化铁,反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,此时TiO2+也会水解生成H2TiO3沉淀,反应的离子方程式为TiO2++2H2O =H2TiO3↓+2H+,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;TiO2++2H2O =H2TiO3↓+2H+;
(6)加热下加入H2O2目的是进一步氧化除去氢氧化亚铁杂质,氧化生成氢氧化铁沉淀;根据(5)的提示,抽滤得到的滤渣中除了含有Fe(OH)3、H2TiO3外,硫酸钙微溶于水,还应该含有加入石灰乳生成的硫酸钙沉淀,加入石灰乳,溶液中的铝离子会生成氢氧化铝沉淀,故答案为:CaSO4、Fe(OH)3、Al(OH)3。


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D四种易溶于水的化合物只由表中的八种离子组成,且四种化合物中阴、阳离子各不相同。
阴离子 | Cl-、SiO32-、OH-、NO3- |
阳离子 | H+、Ag+、Na+、K+ |
已知:A溶液呈强酸性,且A溶液与B、C溶液混合均产生白色沉淀,B的焰色反应呈黄色。
回答下列问题:
(1)写出A、B、C、D的化学式:A______,B_____,C____,D____。
(2)写出A溶液与B溶液反应的离子方程式: __________。
(3)请选出适合存放A、C、D溶液的试剂瓶的序号:

溶液 | A | C | D |
试剂瓶序号 | ___ | ___ | ___ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 邻羟基苯甲醛的沸点比对羟基苯甲醛的高
B. 基态碳原子的最外层电子排布图:![]()
C. 原子核外价电子排布式分别为3s1和3s23p5两种元素,不能形成AB2型化合物
D. 原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质相似
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在我国南海、东海海底均存在大量的可燃冰(天然气水合物,可表示为![]() )。
)。
2017年5月,中国首次海域可燃冰试采成功。2017年11月3日,国务院正式批准将可燃冰列为新矿种。可燃冰的开采和利用,既有助于解决人类面临的能源危机,又能生成一系列的工业产品。
(1)对某可燃冰矿样进行定量分析,取一定量样品,释放出的甲烷气体体积折合成标准状况后为166 m3,剩余 H2O 的体积为0.8m3,则该样品的化学式中 x=_________________。
(2)已知下表数据,且知 H2O(l)=H2O(g) △H=+41![]()
化学键 | C—H | O=O | C=O | H—O |
键能/ | 413 | 498 | 803 | 463 |
用甲烷燃烧热表示的热化学方程式为_____________________________________________________。
(3)甲烷燃料电池相较于直接燃烧甲烷有着更高的能量转化效率,某甲烷燃料电池,正极通入空气,以某种金属氧化物为离子导体(金属离子空穴中能传导 O2-),该电池负极的电极反应式为__________________________________________。
(4)甲烷与水蒸气重整制氢是工业上获得氢气的重要手段。若甲烷与脱盐水在一定条件下反应生成H2,同时得到体积比为1:3的CO2和CO,该反应的化学方程式为_____________________________________。混合气体中的CO2可用浓氨水脱除,同时获得氮肥NH4HCO3,该反应的离子方程式是_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2 加氢合成甲醇是合理利用 CO2 的有效途径。由 CO2 制备甲醇过程可能涉及反应如下:
反应Ⅰ:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1
CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1
反应Ⅱ:CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
反应Ⅲ:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1
回答下列问题:
(1)反应Ⅲ的 ΔS_____(填“<”、“=”或“>”)0;反应Ⅱ的 ΔH2=_____。

(2)在恒压密闭容器中,充入一定量的 H2 和 CO2(假定仅发生反应Ⅲ),实验测得反应物在不同温度下,反应体系中 CO2 的平衡转化率与压强的关系曲线如图所示。
①比较T1与T2 的大小关系:T1_____T2 (填“ < ”、“= ”或“> ”) ,理由是:_____。
②在 T1 和 p6 的条件下,往密闭容器中充入 3 mol H2 和 1 mol CO2,该反应在第 5 min 时达到平衡,此时容器的体积为 1.8 L,则该反应在此温度下的平衡常数为_____。
a.若此条件下反应至 3 min 时刻,改变条件并于 A 点处达到平衡,CH3OH 的浓度随反应时间的变化趋势如图所示(3~4 min 的浓度变化未表示出来),则改变的条件为_____,请用 H2 的浓度变化计算从4 min 开始到A点的反应速率v(H2)=_____(保留两位小数)。
b.若温度不变,压强恒定在 p8 的条件下重新达到平衡时,容器的体积变为_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示2套实验装置,分别回答下列问题。

(1)装置1为铁的吸氧腐蚀实验。一段时间后,取玻璃筒内的溶液滴入铁氰化钾溶液,可观察到蓝色沉淀,表明铁被__________(填“氧化“或“还原”);向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为______________________。
(2)装置2中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红。
①电源的M端为__________极;甲烧杯中Cu电极的电极反应为__________。
②乙烧杯中电解反应的离子方程式为______________________________。
③取出乙溶液中Cu电极,洗涤、干燥、称量、电极增重0.64 g,甲烧杯中石墨电极产生的气体标准状况下体积为__________mL。若想使乙烧杯中电解质溶液复原,可以加入的物质是:__________(填字母)。(Cu的原子量为64)
A. CuO B. Cu(OH)2 C. Cu2(OH)2CO3 D. CuCO3 E. CuSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂以重晶石(主要含BaSO4)为原料,生产“电子陶瓷工业支柱”——钛酸(BaTiO3)的工艺流程如下:
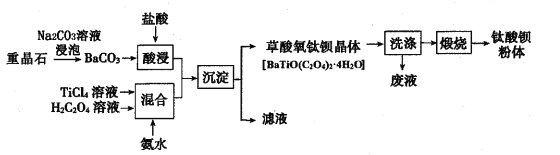
回答下列问题:
(l)为提高BaCO3的酸浸速率,可采取的措施为__(写出一条即可);常温下,TiCl4为液体且易水解,配制一定浓度的TiCl4溶液的方法是 ____。
(2)用Na2CO3溶液浸泡重晶石(假设杂质不与Na2CO3反应),能将BaSO4转化为BaCO3,此反应的平衡常数K= ___(填写计算结果);若不考虑CO32-的水解,要使2. 33g BaSO4恰好完全转化为BaCO3,则至少需要浓度为1.0mol·L-1Na2CO3溶液 ___mL。(已知:Ksp(BaSO4)=1.0×10-10、Ksp(BaCO3)=5.0×10-9)
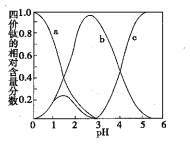
(3)流程中“混合”溶液的钛元素在不同pH时主要以TiO(OH)+、TiOC2O4、TiO(C2O4)22-三种形式存在(变化曲线如右图所示)。实际制备工艺中,先用氨水调节混合溶液的pH于2.8左右,再进行“沉淀”,其反应的离子方程式为____;图中曲线c对应钛的形式为____(填粒子符号)。
(4)流程中“滤液”的主要成分为____;隔绝空气煅烧草酸氧钛钡晶体得到钛酸钡粉体和气态产物,试写出反应的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中处处有化学,下列有关说法正确的是
A.天然弱碱性水呈碱性的原因是其中含有较多的Mg2+、Ca2+等离子
B.焊接时用NH4Cl溶液除锈与盐类水解无关
C.生活中用电解食盐水的方法制取消毒液,运用了盐类的水解原理
D.在滴有酚酞的Na2CO3溶液中慢慢滴入BaCl2溶液,溶液的红色逐渐褪去
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com