
【题目】25℃时,向0.1mol·L-1NaA溶液中逐滴滴加盐酸,测得混合溶液的pH与p![]() 变化关系如图所示[
变化关系如图所示[![]() =-lg
=-lg![]() ]。下列说法正确的是
]。下列说法正确的是

A. a点溶液中c(Na+)=c(A-)
B. 电离常数K(HA)的数量级为10-4
C. 滴加过程中![]() 不断减小
不断减小
D. b点溶液中c(HA)>c(Na+)>c(A-)>c(OH-)
【答案】B
【解析】
由图可知,25℃时,0.1mol·L-1NaA溶液与盐酸反应生成氯化钠和HA,a点时,溶液呈中性,溶液中c(H+)=c(OH-);b 点时,溶液呈酸性;c点时,溶液中c(A-)=c(HA),K(HA)=c(H+)。
A项、a 点pH=7,溶液呈中性,溶液中c(H+)=c(OH-),溶液中的电荷守恒关系为c(Na+)+c(H+)= c(OH-)+c(A-)+c(Cl-),则c(Na+)=c(A-)+c(Cl-),故A 错误;
B项、K(HA)= ![]() ,c点时,溶液中c(A-)=c(HA),根据 c点坐标(0,3. 45)可求知 K(HA)=c(H+)=10-3.45,数量级为10-4,故B 正确;
,c点时,溶液中c(A-)=c(HA),根据 c点坐标(0,3. 45)可求知 K(HA)=c(H+)=10-3.45,数量级为10-4,故B 正确;
C项、滴加过程中![]() =
=![]() =
=![]() ,一定温度下 K(HA)、Kw均为常数,故
,一定温度下 K(HA)、Kw均为常数,故![]() 保持不变,故C错误;
保持不变,故C错误;
D项、根据 b 点坐标(-1,5),可知 c(OH-)=1.0×10—9molL—1,![]() =10,即 c(A-)>c(HA),再根据溶液中始终存在的物料守恒c(Na+)=c(A-)+c(HA)可知,溶液中c(Na+)>c( A-),则b点溶液中c(Na+)>c(A-)>c(HA)>c(OH-),故D错误。
=10,即 c(A-)>c(HA),再根据溶液中始终存在的物料守恒c(Na+)=c(A-)+c(HA)可知,溶液中c(Na+)>c( A-),则b点溶液中c(Na+)>c(A-)>c(HA)>c(OH-),故D错误。
故选B。


 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】如图所示装置中观察到电流计指针偏转,M棒变粗、N棒变细,以此判断下表中所列M、N、P物质,其中可以成立的是

选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2 加氢合成甲醇是合理利用 CO2 的有效途径。由 CO2 制备甲醇过程可能涉及反应如下:
反应Ⅰ:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1
CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1
反应Ⅱ:CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
反应Ⅲ:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1
回答下列问题:
(1)反应Ⅲ的 ΔS_____(填“<”、“=”或“>”)0;反应Ⅱ的 ΔH2=_____。

(2)在恒压密闭容器中,充入一定量的 H2 和 CO2(假定仅发生反应Ⅲ),实验测得反应物在不同温度下,反应体系中 CO2 的平衡转化率与压强的关系曲线如图所示。
①比较T1与T2 的大小关系:T1_____T2 (填“ < ”、“= ”或“> ”) ,理由是:_____。
②在 T1 和 p6 的条件下,往密闭容器中充入 3 mol H2 和 1 mol CO2,该反应在第 5 min 时达到平衡,此时容器的体积为 1.8 L,则该反应在此温度下的平衡常数为_____。
a.若此条件下反应至 3 min 时刻,改变条件并于 A 点处达到平衡,CH3OH 的浓度随反应时间的变化趋势如图所示(3~4 min 的浓度变化未表示出来),则改变的条件为_____,请用 H2 的浓度变化计算从4 min 开始到A点的反应速率v(H2)=_____(保留两位小数)。
b.若温度不变,压强恒定在 p8 的条件下重新达到平衡时,容器的体积变为_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示2套实验装置,分别回答下列问题。

(1)装置1为铁的吸氧腐蚀实验。一段时间后,取玻璃筒内的溶液滴入铁氰化钾溶液,可观察到蓝色沉淀,表明铁被__________(填“氧化“或“还原”);向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为______________________。
(2)装置2中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红。
①电源的M端为__________极;甲烧杯中Cu电极的电极反应为__________。
②乙烧杯中电解反应的离子方程式为______________________________。
③取出乙溶液中Cu电极,洗涤、干燥、称量、电极增重0.64 g,甲烧杯中石墨电极产生的气体标准状况下体积为__________mL。若想使乙烧杯中电解质溶液复原,可以加入的物质是:__________(填字母)。(Cu的原子量为64)
A. CuO B. Cu(OH)2 C. Cu2(OH)2CO3 D. CuCO3 E. CuSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G是一种神经保护剂的中间体,某种合成路线如下:

根据上述转化关系,回答下列问题:
(1)芳香族化合物A的名称是___。
(2)D中所含官能团的名称是____。
(3)B—C的反应方程式为____。
(4)F—G的反应类型___。
(5)G的同分异构体能同时满足下列条件的共有____种(不含立体异构);
①芳香族化合物②能发生银镜反应,且只有一种官能团,其中,核磁共振氢谱显示为4组峰,且峰面积比为1:2:2:3的是__(写出一种结构简式)。
(6)参照上述合成路线,写出以![]() 和BrCH2COOC2H5为原料(无机试剂任选),制备
和BrCH2COOC2H5为原料(无机试剂任选),制备 的合成路线____________。
的合成路线____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂以重晶石(主要含BaSO4)为原料,生产“电子陶瓷工业支柱”——钛酸(BaTiO3)的工艺流程如下:
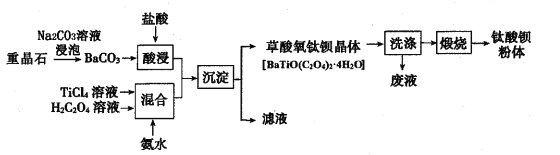
回答下列问题:
(l)为提高BaCO3的酸浸速率,可采取的措施为__(写出一条即可);常温下,TiCl4为液体且易水解,配制一定浓度的TiCl4溶液的方法是 ____。
(2)用Na2CO3溶液浸泡重晶石(假设杂质不与Na2CO3反应),能将BaSO4转化为BaCO3,此反应的平衡常数K= ___(填写计算结果);若不考虑CO32-的水解,要使2. 33g BaSO4恰好完全转化为BaCO3,则至少需要浓度为1.0mol·L-1Na2CO3溶液 ___mL。(已知:Ksp(BaSO4)=1.0×10-10、Ksp(BaCO3)=5.0×10-9)
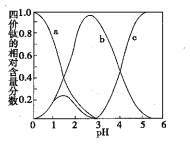
(3)流程中“混合”溶液的钛元素在不同pH时主要以TiO(OH)+、TiOC2O4、TiO(C2O4)22-三种形式存在(变化曲线如右图所示)。实际制备工艺中,先用氨水调节混合溶液的pH于2.8左右,再进行“沉淀”,其反应的离子方程式为____;图中曲线c对应钛的形式为____(填粒子符号)。
(4)流程中“滤液”的主要成分为____;隔绝空气煅烧草酸氧钛钡晶体得到钛酸钡粉体和气态产物,试写出反应的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在一固定容积的密闭容器中发生反应:A(g)+B(g)![]() C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是
C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是

A. T℃时,该反应的平衡常数值为4
B. c点没有达到平衡,此时反应向逆向进行
C. 若c点为平衡点,则此时容器内的温度高于T℃
D. T℃时,直线cd上的点均为平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. C3H6C12有4种同分异构体
B. 乙烯与Br2的CCl4溶液反应后,混合液分为两层
C. 乙醇被氧化一定生成乙醛
D. 合成材料会造成巨大的环境压力,应禁止使用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com