
【题目】下列关于有机化合物的说法正确的是
A. C3H6C12有4种同分异构体
B. 乙烯与Br2的CCl4溶液反应后,混合液分为两层
C. 乙醇被氧化一定生成乙醛
D. 合成材料会造成巨大的环境压力,应禁止使用
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】25℃时,向0.1mol·L-1NaA溶液中逐滴滴加盐酸,测得混合溶液的pH与p![]() 变化关系如图所示[
变化关系如图所示[![]() =-lg
=-lg![]() ]。下列说法正确的是
]。下列说法正确的是

A. a点溶液中c(Na+)=c(A-)
B. 电离常数K(HA)的数量级为10-4
C. 滴加过程中![]() 不断减小
不断减小
D. b点溶液中c(HA)>c(Na+)>c(A-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在某密闭容器中发生反应:2HI(g)![]() H2(g)+I2(g) ΔH>0,若15s内c(HI)由0.1mol·L-1降到0.07mol·L-1,则下列说法正确的是( )
H2(g)+I2(g) ΔH>0,若15s内c(HI)由0.1mol·L-1降到0.07mol·L-1,则下列说法正确的是( )
A. 0~15 s内用I2表示的平均反应速率为v(I2)=0.002 mol·L-1·s-1
B. c(HI)由0.07 mol·L-1降到0.05 mol·L-1所需的反应时间小于10 s
C. 升高温度正反应速率加快,逆反应速率减慢
D. 减小反应体系的体积,化学反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空。下面列出了几组物质,请将物质的合适组号填写在空格上。
A.金刚石与石墨;B.氕与氘;C.甲烷与戊烷;D.![]() 与
与 ;E.
;E.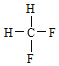 与
与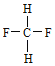 。
。
(1)同素异形体___;(2)同系物___;(3)同分异构体___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁晶体{[CH3CH(OH)COO]2Fe·3H2O,相对分子质量为288}易溶于水,是一种很好的补铁剂,可由乳酸[CH3 CH(OH)COOH]与FeCO3反应制得。
I.碳酸亚铁的制备(装置如下图所示)

(1)仪器B的名称是____;实验操作如下:打开kl、k2,加入适量稀硫酸,关闭kl,使反应进行一段时间,其目的是____。
(2)接下来要使仪器C中的制备反应发生,需要进行的操作是____,其反应的离子方程式为____。
(3)仪器C中混合物经过滤、洗涤得到FeCO3沉淀,检验其是否洗净的方法是____。
Ⅱ.乳酸亚铁的制各及铁元素含量测定
(4)向纯净FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应,经过滤,在____的条件下,经低温蒸发等操作后,获得乳酸亚铁晶体。
(5)两位同学分别用不同的方案进行铁元素含量测定:
①甲同学通过KMnO4滴定法测定样品中Fe2+的含量计算样品纯度。在操作均正确的前提下,所得纯度总是大于l00%,其原因可能是 ___。
②乙同学经查阅资料后改用碘量法测定铁元素的含量计算样品纯度。称取3.000g样品,灼烧完全灰化,加足量盐酸溶解,取所有可溶物配成l00mL溶液。吸取25.00 rnL该溶液加入过量KI溶液充分反应,然后加入几滴淀粉溶液,用0. 100 mol·L-1硫代硫酸钠溶液滴定(已知:I2+2S2O32-=S4O62-+2I-),当溶液____,即为滴定终点;平行滴定3次,硫代硫酸钠溶液的平均用量为24. 80 mL,则样品纯度为____%(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用VSEPR推断分子或离子的空间构型。
PO![]() __________;CS2____________;AlBr3(共价分子)__________。
__________;CS2____________;AlBr3(共价分子)__________。
(2)有两种活性反应中间体粒子,它们的粒子中均含有1个碳原子和3个氢原子。请依据下面给出的这两种粒子的球棍模型,写出相应的化学式:
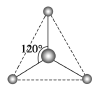 ______________;
______________;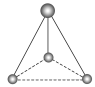 ______________。
______________。
(3)按要求写出第二周期非金属元素构成的中性分子的化学式。
平面三角形分子________,三角锥形分子________,四面体形分子________。
(4)为了解释和预测分子的空间构型,科学家在归纳了许多已知的分子空间构型的基础上,提出了一种十分简单的理论模型——价层电子对互斥模型。这种模型把分子分成两类:一类是____________________;另一类是____________________。
BF3和NF3都是四个原子的分子,BF3的中心原子是________,NF3的中心原子是________;BF3分子的立体构型是平面三角形而NF3分子的立体构型是三角锥形的原因是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类农业生产离不开氮肥,科学合理使用氮肥,不仅能提高化肥的使用率,而且能够更好地保护环境,请回答下列问题:
(1)将N2转化为含氮化合物的过程称为固氮。
①人工固氮,将N2→NH3,N2发生___反应(填“氧化”或“还原”)
②自然界固氮,可将少量N2转化为Ca(NO3)2等氮肥,转化途径如下(转化所需试剂及条件已略去):N2→NO→NO2→HNO3![]() Ca(NO3)2。
Ca(NO3)2。
写出NO→NO2→HNO3的化学方程式___、___。
将HNO3转化为Ca(NO3)2,列举两种不同类别的化合物M___(写化学式)。
(2)科学合理地保存、施用氮肥。
①NH4HCO3需阴凉处保存,原因是___(写化学方程式)。
②铵态氮肥不能与碱性肥料混合使用,以NH4Cl为例写出发生反应的离子方程式___。
(3)过渡施用氮肥将导致大气中NH3含量增高,加剧雾霾的形成。(NH4)2SO4是雾霾的成分之一,其形成过程如图所示(转化所需试剂及条件已略去):

①Y与NH3反应生成(NH4)2SO4的化学方程式___。
②尿素CO(NH2)2是一种常用化肥,缓慢与H2O发生非氧化还原反应释放出NH3。则尿素中C元素化合价为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,自远古时代人类就学会了炼铁,到目前为止,人类研制出了很多炼铁的方法。某研究性学习小组同学在实验室中模拟工业炼铁的过程,实验装置如下:
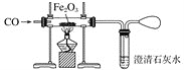
(1)写出得到单质铁的化学方程式:_________________________。
(2)实验过程中看到玻璃管内的粉末由红棕色逐渐变黑,请设计一个实验来验证生成了单质铁:______。
(3)装置末端气球的作用为_____________________________。实验结束时,应该先停止加热还是先停止通入CO?原因是什么?_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】感冒是一种常见的病,病人患了感冒会咳嗽、流涕、发烧,多喝开水多休息,适当服用一些治疗感冒的药,可以舒缓症状,减轻病情。药物阿司匹林是一种传统的治疗感冒发烧的药,从分子结构上看,它可以看做是乙酸酯,其结构简式为
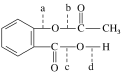
(1)阿司匹林与NaOH溶液反应中,可以断裂的化学键是________(填代号)。
(2)根据阿司匹林的结构推断它能够发生的化学反应类型为________(填序号)。
①中和反应 ②加成反应 ③取代反应
(3)阿司匹林连接在某高分子聚合物上,可形成缓解长效药物,其中的一种结构为
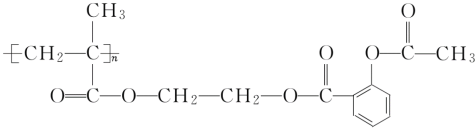
则缓释长效阿司匹林载体的结构简式为_______。
(4)长期大量服用阿司匹林会出现不良反应,一旦出现水杨酸中毒现象,应立即停药,并静脉滴注NaHCO3溶液,以解除水杨酸的中毒症状,反应的化学方程式为_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com