
【题目】X、Y、Z为元素周期表中的短周期元素,它们在周期表中的位置关系如图所示,下列推断正确的是

A.无法推断出X、Y、Z的具体元素
B.Y可能是F元素
C.Z的最高价氧化物对应水化物的酸性比Y的强
D.X、Y两种元素形成的最简单化合物比X、Z形成的最简单化合物稳定
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E四种元素,它们原子的核电荷数均小于18,且依次递增,A原子核内仅有一个质子;B原子的电子总数与D原子的最外层电子数相等;A原子与B原子的最外层电子数之和与C原子的最外层电子数相等;D的最外层电子数是次外层电子数的3倍;E的单质是用途最广泛的半导体材料。试推断它们各是什么元素并回答下列问题:
(1)写出它们的元素符号:A________,B________,C________,D________,E________。
(2)B、C、D的气态氢化物的稳定性由大到小的顺序为__________(用化学式表示)
(3)画出D的离子结构示意图________。
(4)用一个方程式证明B、E的非金属性的强弱_______________。
(5)写出E的最高价氧化物的一种用途:_________。
(6)由这五种元素组成的三核10电子的分子为________,四核10电子的分子是________。由这五种元素组成的四核18电子的分子为________,五核18电子的分子是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2N-NH2)和偏二甲肼[H2N-N(CH3)2]均可用作火箭燃料。查阅资料得知,肼是一种良好的极性溶剂,沿肼分子球棍模型的氮、氮键方向观察,看到的平面图如下图所示。下列说法不正确的是
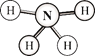
A.肼分子中的氮原子采用sp3杂化
B.肼分子中既有极性键又有非极性键
C.肼分子是非极性分子
D.肼与偏二甲肼互称同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,R与Y处于同一主族,Z是短周期中金属性最强的金属元素, W的最高价氧化物对应水化物能与Z、R的最高价氧化物对应水化物均反应生成盐和水。下列说法正确的是
A.元素Y、Z、W离子具有相同的电子层结构,其半径依次增大
B.元素X与元素Y能形成两种化学键类型完全相同的化合物
C.元素Y、R分别与元素X形成的化合物的热稳定性: XmY>XmR
D.元素X、Z形成化合物的电子式可以表示成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
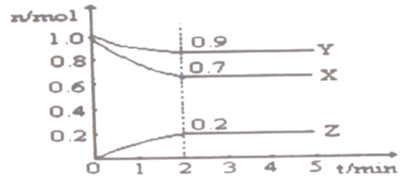
(1)该反应的化学方程式为____
(2)反应开始至2min,以Z表示的平均反应速率为____
(3)该反应为放热反应,能使该反应的反应速率增大的是____
A.及时分离出Z气体 B.适当降低温度 C.增大Y的浓度 D.选择高效催化剂
(4)2min后反应达到平衡,此时容器内混合气体的平均相对分子质量比起始投料时____(填“增大”“减小”或“相等”)
(5)可以判断上述反应已经达到平衡的是____
A.密闭容器中总压强不变
B.密闭容器中混合气体的密度不变
C.混合气体的平均相对分子质量不再改变
D.n(A):n(B):n(C)等于化学计量系数之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4-溴甲基-1-环己烯的一种合成路线如下,下列说法正确的是
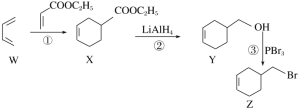
A.X、Y、Z都属于芳香族化合物
B.①②③的反应类型依次为加成反应、还原反应和取代反应
C.由化合物Z一步制备化合物Y的转化条件是:NaOH醇溶液,加热
D.化合物Y先经酸性高锰酸钾溶液氧化,再与乙醇在浓硫酸催化下酯化可制得化合物X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等电子体的结构相似、物理性质相近,称为等电子原理。如N2和CO为等电子体。
(1)由第二周期元素组成,与F2互为等电子体的离子是____,与C2O42-互为等电子体的分子是____。
(2)Mn原子在元素周期表中的位置是____,价电子排布为____。
(3)往CuSO4溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。该离子的结构式为____,已知NF3与NH3的立体构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将表面被氧化为Na2O、Na2O2的金属钠1.1g投入水中,收集到224mL气体(标准状况),该气体引爆后,冷却到原状态时,剩余气体为56mL。则Na、Na2O、Na2O2的质量分别为_____________克?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com