
【题目】A、B、C是中学化学中常见的三种元素(A、B、C代表元素符号)。A位于元素周期表中第四周期,其基态原子最外层电子数为2,且内层轨道全部排满电子。短周期元素B的一种常见单质为淡黄色粉末。元素C的原子最外层电子数是其内层电子数的3倍。
(1)在第三周期中,第一电离能大于B的元素有____种。
(2)B的氢化物(H2B)分子的立体构型为____,C的氢化物H2C、H2C2中C的杂化类型分别是________、____,在乙醇中的溶解度:S(H2C)>S(H2B),其原因是____。
(3)A的氯化物与氨水反应可形成配合物[A(NH3)4]Cl2,1mol该配合物中含有σ键的物质的量为____mol。
【答案】3 V形(或角形) sp3 sp3 水分子与乙醇分子之间形成氢键 16
【解析】
A、B、C是中学化学中常见的三种元素,A位于元素周期表中第4周期,其基态原子最外层电子数为2,且内层轨道全部排满电子,核外电子排布为1s22s22p63s23p63d104s2,为Zn元素;短周期元素B的一种常见单质为淡黄色粉末,则B为S元素;C的原子最外层电子数是其内层电子数的3倍,C原子只能有2个电子层,最外层电子数为6,则C为O元素,据此分析解答。
根据上述分析,A为Zn元素,B为S元素,C为O元素。
(1)在第3周期中,第一电离能大于S的元素有P、Cl、Ar,故答案为:3;
(2)H2S分子中S原子的价层电子对数为2+![]() =4,S原子有2对孤电子对,故其空间构型为V型;C的氢化物H2O、H2O2中O原子的价层电子对数分别为2+
=4,S原子有2对孤电子对,故其空间构型为V型;C的氢化物H2O、H2O2中O原子的价层电子对数分别为2+![]() =4,3+
=4,3+![]() =4,杂化类型分别都是sp3杂化;水分子与乙醇分子之间能够形成氢键,故在乙醇中的溶解度:S(H2O)>S(H2S),故答案为:V型;sp3;sp3;水分子与乙醇分子之间形成氢键;
=4,杂化类型分别都是sp3杂化;水分子与乙醇分子之间能够形成氢键,故在乙醇中的溶解度:S(H2O)>S(H2S),故答案为:V型;sp3;sp3;水分子与乙醇分子之间形成氢键;
(3)Zn的氯化物与氨水反应可形成配合物[Zn(NH3)4]Cl2,[Zn(NH3)4]2+中含有12个N-H键、4个配位键,故含有16个σ键,则1mol该配合物中含有σ键的物质的量为16mol,故答案为:16。


科目:高中化学 来源: 题型:
【题目】有五种元素X、Y、Z、Q、T。X元素为主族元素,X原子的M层上有两个未成对电子且无空轨道;Y原子的价电子排布式为3d64s2;Z原子的![]() 电子层的p能级上有一个空轨道;Q原子的L电子层的p能级上只有一对成对电子;T原子的M电子层上p轨道半充满。下列叙述不正确的是( )
电子层的p能级上有一个空轨道;Q原子的L电子层的p能级上只有一对成对电子;T原子的M电子层上p轨道半充满。下列叙述不正确的是( )
A.元素Y和Q可形成化合物Y2Q3
B.X与![]() 的最高价氧化物对应的水化物,前者的酸性比后者强
的最高价氧化物对应的水化物,前者的酸性比后者强
C.X和Q结合生成的化合物为离子化合物
D.ZQ2是由极性键构成的非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2N-NH2)和偏二甲肼[H2N-N(CH3)2]均可用作火箭燃料。查阅资料得知,肼是一种良好的极性溶剂,沿肼分子球棍模型的氮、氮键方向观察,看到的平面图如下图所示。下列说法不正确的是
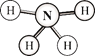
A.肼分子中的氮原子采用sp3杂化
B.肼分子中既有极性键又有非极性键
C.肼分子是非极性分子
D.肼与偏二甲肼互称同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
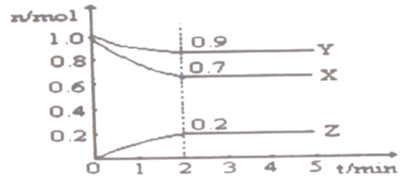
(1)该反应的化学方程式为____
(2)反应开始至2min,以Z表示的平均反应速率为____
(3)该反应为放热反应,能使该反应的反应速率增大的是____
A.及时分离出Z气体 B.适当降低温度 C.增大Y的浓度 D.选择高效催化剂
(4)2min后反应达到平衡,此时容器内混合气体的平均相对分子质量比起始投料时____(填“增大”“减小”或“相等”)
(5)可以判断上述反应已经达到平衡的是____
A.密闭容器中总压强不变
B.密闭容器中混合气体的密度不变
C.混合气体的平均相对分子质量不再改变
D.n(A):n(B):n(C)等于化学计量系数之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4-溴甲基-1-环己烯的一种合成路线如下,下列说法正确的是
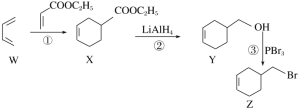
A.X、Y、Z都属于芳香族化合物
B.①②③的反应类型依次为加成反应、还原反应和取代反应
C.由化合物Z一步制备化合物Y的转化条件是:NaOH醇溶液,加热
D.化合物Y先经酸性高锰酸钾溶液氧化,再与乙醇在浓硫酸催化下酯化可制得化合物X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 是四种短周期元素,它们的核电荷数依次增大,四种元素的性质或原子结构的部分信息如表所示。
是四种短周期元素,它们的核电荷数依次增大,四种元素的性质或原子结构的部分信息如表所示。
元素 | 元素性质或原子结构的部分信息 |
| 元素的离子核外无电子 |
| 地壳中含量最多的元素 |
| 元素的离子半径在该周期中最小 |
|
|
下列叙述不正确的是( )
A.![]() 与
与![]() 形成的化合物在常温下为气体
形成的化合物在常温下为气体
B.![]() 的最高价氧化物对应的水化物不与
的最高价氧化物对应的水化物不与![]() 溶液反应
溶液反应
C.![]() 和
和![]() 形成的常见化合物能形成酸雨
形成的常见化合物能形成酸雨
D.简单氢化物的稳定性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等电子体的结构相似、物理性质相近,称为等电子原理。如N2和CO为等电子体。
(1)由第二周期元素组成,与F2互为等电子体的离子是____,与C2O42-互为等电子体的分子是____。
(2)Mn原子在元素周期表中的位置是____,价电子排布为____。
(3)往CuSO4溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。该离子的结构式为____,已知NF3与NH3的立体构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表回答下列问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ |
(1)写出下列元素符号:①______,⑥______,⑦______,⑨______。
(2)在这些元素中,最活泼的金属元素是______(填元素符号,下同),最活泼的非金属元素是______,最不活泼的元素是______。
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的是__________________,碱性最强的是__________________,呈两性的氢氧化物是__________________;三者之间相互反应的化学方程式是____________________________________。
(4)在这些元素(稀有气体元素除外)中,原子半径最小的是__________,原子半径最大的是____。
(5)在③与④中,化学性质较活泼的是__________,怎样用化学实验证明?______________ 在⑧与中,化学性质较活泼的是______,怎样用化学实验证明?________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com