
【题目】室温下,某同学进行CO2与Na2O2反应的探究实验,回答下列问题。
(1)用如图装置制备纯净的CO2
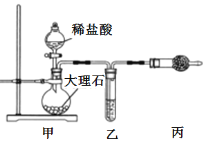
①丙装置的名称是___,乙装置中盛装的试剂是___。
②若CO2 中混有HCl,则HCl与Na2O2反应的化学方程式为____。
(2)按照下面的装置图进行实验(夹持装置略)。
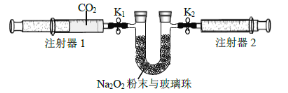
①先组装仪器,然后________,再用注射器1抽取100mL 纯净的CO2,将其连接在K1 处,注射器2的活塞推到底后连接在K2 处,具支U 形管中装入足量的Na2O2 粉末与玻璃珠。
②打开止水夹K1、K2,向右推动注射器1的活塞,可观察到的现象是_____。
③实验过程中反应的化学方程式为_____。
【答案】球形干燥管 饱和NaHCO3溶液 2Na2O2+4HCl=4NaCl+2H2O+O2 检查装置气密性 U形管中的淡黄色粉末逐渐变浅,注射器2的活塞向右移动 2Na2O2+2CO2 =2Na2CO3+O2
【解析】
(1)①由图可知装置丙为干燥管;根据题意制备纯净的二氧化碳,甲装置由稀盐酸与大理石反应制备二氧化碳,制得的二氧化碳中混有氯化氢气体和水蒸气,故乙装置除去氯化氢气体,选择碱性试剂,同时不吸收二氧化碳,故选择饱和碳酸氢钠溶液;
②HCl与Na2O2反应生成氯化钠、氧气和水,化学反应为:2Na2O2+4HCl=4NaCl+2H2O+O2;
(2)①有气体参与的反应前要检查装置气密性;
②打开止水夹K1、K2,向右推动注射器1 的活塞,二氧化碳与过氧化钠反应生成碳酸钠和氧气,2CO2+2Na2O2=2NaCO3+O2,气体减少,可观察到的现象是U形管中的淡黄色粉末逐渐变浅,注射器2的活塞向右移动(或外移动);
③实验过程中反应的化学方程式为2Na2O2+2CO2 =2Na2CO3+O2。


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:

(1)浸锰过程中Fe2O3与SO2反应的化学方程式为Fe2O3+ SO2+2H+=2Fe2++ SO42-+ H2O,该反应是经历以下两步反应实现的。写出ⅱ的离子方程式:_____________。
ⅰ:Fe2O3 + 6H+ = 2Fe3++3H2O
ⅱ:……
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为_____________(填离子符号)。
(3)写出氧化过程中MnO2与SO2反应的化学方程式:_________________。
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是_________;向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是___________________。

(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:___________________。
(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性环境下易分解生成S和
是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性环境下易分解生成S和![]() 。某小组设计了如下实验装置制备
。某小组设计了如下实验装置制备![]() (夹持及加热仪器略),总反应为
(夹持及加热仪器略),总反应为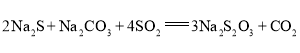 。回答下列问题:
。回答下列问题:
a.![]() b.
b.![]() 粉末 c.
粉末 c.![]() 溶液 d.
溶液 d.![]() 、
、![]() 溶液 e.
溶液 e. ![]() 溶液
溶液
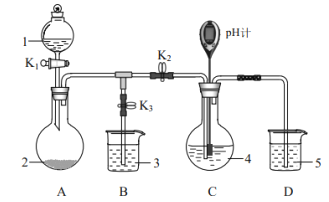
(1)装置A的作用是制备________,反应的化学方程式为________。
(2)完成下表实验过程:
操作步骤 | 装置C的实验现象 | 解释原因 |
检查装置气密性后,添加药品 | pH计读数约为13 | 用离子方程式表示(以 |
打开 | ⅰ.导管口有气泡冒出,② ___ ⅱ. pH计读数逐渐③___ | 反应分步进行:
|
当pH计读数接近7时,立即停止通 | 必须立即停止通 |
(3)![]() 有还原性,可作脱氯剂。向
有还原性,可作脱氯剂。向![]() 溶液中通入少量
溶液中通入少量![]() ,某同学预测
,某同学预测![]() 转变为
转变为![]() ,设计实验验证该预测:取少量反应后的溶液于试管中,________。
,设计实验验证该预测:取少量反应后的溶液于试管中,________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A是石油裂解气的主要成分,A的产量通常来衡量一个国家的石油化工水平;它有如图所示的转化关系。E是具有香味的有机物,F是高分子化合物。
写出下列反应的化学方程式及反应类型:

①_________;反应类型:_____;
②_________;反应类型:_____;
④_________;反应类型:_____;
⑤_________;反应类型:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油裂解可得烃D,其产量是一个国家石油化工发展水平的标志,已知D在标准状况下的密度为1.25 g·Lˉ1。有机物B可利用植物秸秆来生产,E为有香味的油状液体,它们之间的转化关系如图,请回答:

(1)C中所含官能团名称是____。
(2)写出反应④的化学方程式____。
(3)C与D在一定条件下可发生加成反应,生成具有酸性的物质F。F的结构简式为___。
(4)下列说法正确的是____。(填编号)
A.有机物E与F互为同分异构体
B.用新制氢氧化铜悬浊液无法区分有机物B和C
C.有机物A、D均能被酸性高锰酸钾溶液氧化
D.可用饱和NaOH溶液除去有机物E中混有的少量B、C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。这种材料可以按下列方法制备:
SiO2![]() Si(粗)
Si(粗)![]() SiHCl3
SiHCl3![]() Si(纯),下列说法正确的是( )
Si(纯),下列说法正确的是( )
A.步骤①的化学方程式为SiO2+C![]() Si+CO2↑
Si+CO2↑
B.步骤①、②、③中每生成或反应1 mol Si,转移4 mol电子
C.二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D.SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点67.6 ℃),通过蒸馏(或分馏)可提纯SiHCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA 表示阿伏加德罗常数的值)
A.71g Cl2 所含原子数为2NA
B.在常温常压下,22.4L 氦气含有分子数为NA
C.只有在标准状况下,14g氮气含有分子数才为0.5NA
D.在同温同压下,相同体积的任何气体单质所含原子数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种烃,具有下列性质:
①各取0.1mol分别充分燃烧,其中B、C、E燃烧所得的CO2均为4.48L(标准状况),A和D燃烧所得的CO2都是前三者的3倍;
②在适宜条件下,A、B、C都能跟氢气发生加成反应,其中A可以转化为D、B可以转化为C,C可以转化为E;
③B和C都能使溴水或酸性KMnO4溶液褪色,而A、D、E无此性质;
④用铁屑作催化剂时,A可与溴发生取代反应。
(1)判断A、B、D、E各是什么物质,写出下列物质的结构简式:A_______B_______C_______D________E________。
(2)物质E的四氯代物有______种。
(3)写出C与溴的四氯化碳溶液反应的化学方程式:_______
(4)写出④中涉及的化学方程式:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼(![]() )、肼(
)、肼(![]() )和四氧化二氧(
)和四氧化二氧(![]() )可作为运载火箭的推进剂。
)可作为运载火箭的推进剂。
(1)已知:![]()
![]()
![]()
![]()
![]()
![]()
![]() 和
和![]() 反应生成
反应生成![]() 、
、![]() 和
和![]() 并放出大量热,写出该反应的热化学方程式(
并放出大量热,写出该反应的热化学方程式(![]() 用含
用含![]() 、
、![]() 、
、![]() 的代数式表示)__________。该反应______(填“是”或“不是”)自发反应,判断的理由是_______。
的代数式表示)__________。该反应______(填“是”或“不是”)自发反应,判断的理由是_______。
(2)肼(![]() )也可用于新型环保燃料电池中,燃料电池的工作原理示意图如图1所示,该燃料电池的负极反应式为_________________________________。
)也可用于新型环保燃料电池中,燃料电池的工作原理示意图如图1所示,该燃料电池的负极反应式为_________________________________。
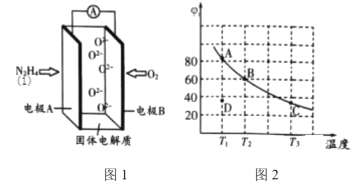
(3)将4molN2O4放入2 L,恒容密闭容器中发生反应N2O4(g) ![]() 2NO2(g),平衡体系中N2O4的体积分数(
2NO2(g),平衡体系中N2O4的体积分数(![]() )随温度的变化如图2所示
)随温度的变化如图2所示
①D点v(正)________v(逆)(填“>”“=”或“<”)。
②A、B、C点中平衡常数K的值最大的是________点。![]() 时,N2O4的平衡转化率为________;若达平衡时间为5 s,则此时间内的
时,N2O4的平衡转化率为________;若达平衡时间为5 s,则此时间内的![]() 平均反应速率为________。
平均反应速率为________。
③若其条件不变,在![]() 原平衡基础上,再加入一定量
原平衡基础上,再加入一定量![]() ,达到新平衡时,与原平衡相比,NO2的体积分数________(填“增大”“不变”或“减小”)。
,达到新平衡时,与原平衡相比,NO2的体积分数________(填“增大”“不变”或“减小”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com