
【题目】![]() 是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性环境下易分解生成S和
是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性环境下易分解生成S和![]() 。某小组设计了如下实验装置制备
。某小组设计了如下实验装置制备![]() (夹持及加热仪器略),总反应为
(夹持及加热仪器略),总反应为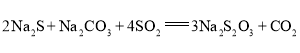 。回答下列问题:
。回答下列问题:
a.![]() b.
b.![]() 粉末 c.
粉末 c.![]() 溶液 d.
溶液 d.![]() 、
、![]() 溶液 e.
溶液 e. ![]() 溶液
溶液
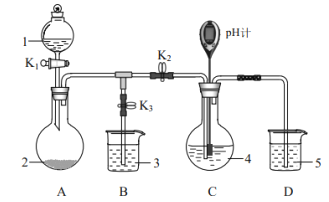
(1)装置A的作用是制备________,反应的化学方程式为________。
(2)完成下表实验过程:
操作步骤 | 装置C的实验现象 | 解释原因 |
检查装置气密性后,添加药品 | pH计读数约为13 | 用离子方程式表示(以 |
打开 | ⅰ.导管口有气泡冒出,② ___ ⅱ. pH计读数逐渐③___ | 反应分步进行:
|
当pH计读数接近7时,立即停止通 | 必须立即停止通 |
(3)![]() 有还原性,可作脱氯剂。向
有还原性,可作脱氯剂。向![]() 溶液中通入少量
溶液中通入少量![]() ,某同学预测
,某同学预测![]() 转变为
转变为![]() ,设计实验验证该预测:取少量反应后的溶液于试管中,________。
,设计实验验证该预测:取少量反应后的溶液于试管中,________。
【答案】![]()
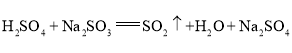
![]() 溶液出现淡黄色浑浊,然后逐渐澄清(或浑浊减少) 减小 关闭
溶液出现淡黄色浑浊,然后逐渐澄清(或浑浊减少) 减小 关闭![]() 、
、![]() ,打开
,打开![]()
![]() 过量会使溶液酸度增加,使产物分解,降低产率 加入过量盐酸,过滤,向滤液中滴加Ba
过量会使溶液酸度增加,使产物分解,降低产率 加入过量盐酸,过滤,向滤液中滴加Ba![]() 溶液,有白色沉淀生成
溶液,有白色沉淀生成
【解析】
(1)装置A中试剂1为浓硫酸,试剂2为Na2SO3,反应生成二氧化硫气体;
(2)检查装置气密性后,添加药品,pH计读数约为13说明溶液显碱性是硫离子水解的原因;打开K2,关闭K3,调节K1使硫酸缓慢匀速滴下,反应分步进行:
Na2CO3+SO2═Na2SO3+CO2
2Na2S+3SO2═2Na2SO3+3S↓
Na2SO3+S═Na2S2O3(较慢)
发生总反应为2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2,据此分析反应现象;
当pH计读数接近7时,立即停止通SO2,SO2过量会使溶液酸度增加,使产物分解,降低产率,操作是关闭K1、K2,打开K3;
(3)预测S2O32-转变为SO42-,可以利用检验硫酸根离子的方法设计实验检验;
(1)装置A中试剂1为浓硫酸,试剂2为Na2SO3,反应生成二氧化硫气体,反应的化学方程式为:H2SO4+Na2SO3=SO2↑+H2O+Na2SO4,
故答案为SO2;H2SO4+Na2SO3=SO2↑+H2O+Na2SO4;
(2)检查装置气密性后,添加药品,pH计读数约为13说明溶液显碱性是硫离子水解,水解离子方程式为:S2+H2OHS+OH,
打开K2,关闭K3,调节K1使硫酸缓慢匀速滴下,反应分步进行:
Na2CO3+SO2═Na2SO3+CO2
2Na2S+3SO2═2Na2SO3+3S↓
Na2SO3+S═Na2S2O3(较慢)
发生总反应为2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2,
反应过程中的现象是导管口有气泡冒出,溶液出现淡黄色浑浊,然后逐渐澄清(或浑浊减少),碳酸钠溶液变化为亚硫酸钠溶液和硫代硫酸钠溶液,pH计读数逐渐减小
当pH计读数接近7时,立即停止通SO2,操作是关闭K1、K2,打开K3,必须立即停止通SO2的原因是:SO2过量会使溶液酸度增加,使产物分解,降低产率,
故答案为S2+H2OHS+OH;溶液出现淡黄色浑浊,然后逐渐澄清(或浑浊减少);减小;关闭K1、K2,打开K3;SO2过量会使溶液酸度增加,使产物分解,降低产率;
(3)Na2S2O3有还原性,可作脱氯剂。向Na2S2O3溶液中通入少量Cl2,某同学预测S2O32转变为SO42,设计实验为:取少量反应后的溶液于试管中,加入过量盐酸,过滤,向滤液中滴加BaCl2溶液,有白色沉淀生成,
故答案为加入过量盐酸,过滤,向滤液中滴加


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,基态X原子核外电子s能级电子数是p能级电子数的4倍,![]() 、中电子总数为10,Z是电负性最大的元素。下列说法错误的是( )
、中电子总数为10,Z是电负性最大的元素。下列说法错误的是( )
A.原子半径:X>Y>Z>WB.![]() 中Y的杂化类型为
中Y的杂化类型为![]() 杂化
杂化
C.![]() 分子的空间构型为三角锥形D.分子
分子的空间构型为三角锥形D.分子![]() 中存在配位键
中存在配位键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是
A. 用排水法收集铜粉与浓硝酸反应产生的NO2
B. 用氨水鉴别NaCl、MgCl2、AlCl3、NH4Cl四种溶液
C. 用酸性KMnO4溶液验证草酸的还原性
D. 用饱和NaHCO3溶液除去Cl2中混有的HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿原酸的结构简式如图,下列有关绿原酸的说法错误的是( )
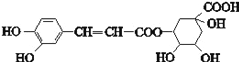
A. 分子式为C16H18O9 B. 能与NaHCO3反应
C. 能发生取代反应、氧化反应和消去反应 D. 1 mol绿原酸最多与6 mol Br2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某(NH4)2CO3和(NH4)2SO4的固体混合物含氮量为23.3%。
(1)取9.0g该混合物,加入足量浓NaOH溶液,加热,产生的气体在标准状况下体积为________________L(保留2位小数)。
(2)向上述反应后的混合溶液中再加入足量稀盐酸,产生560mL气体(标准状况)。列式计算原固体混合物中(NH4)2CO3和(NH4)2SO4的物质的量之比。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应NH4Cl+NaNO2=NaCl + N2↑+2H2O放热且产生气体。下列表示反应中相关微粒的化学用语正确的是
A.中子数为12的钠原子:![]() B.N2的结构式: N=N
B.N2的结构式: N=N
C.O2-的结构示意图:![]() D.NaCl 的电子式:
D.NaCl 的电子式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一种广泛使用的高分子材料助剂的结构简式,下列说法正确的是( )(CH3CH2CH2CH3可表示为![]()
![]()

A.该有机物的分子式为C24H40O4
B.1mol该有机物与氢气发生加成反应,最多消耗5mol氢气
C.该有机物在氢氧化钠作用下发生水解反应得到三种有机物
D.该有机物在FeBr3存在下与液溴发生取代反应生成两种一溴代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某同学进行CO2与Na2O2反应的探究实验,回答下列问题。
(1)用如图装置制备纯净的CO2
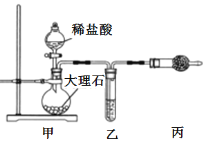
①丙装置的名称是___,乙装置中盛装的试剂是___。
②若CO2 中混有HCl,则HCl与Na2O2反应的化学方程式为____。
(2)按照下面的装置图进行实验(夹持装置略)。
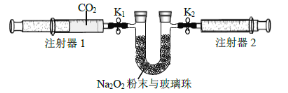
①先组装仪器,然后________,再用注射器1抽取100mL 纯净的CO2,将其连接在K1 处,注射器2的活塞推到底后连接在K2 处,具支U 形管中装入足量的Na2O2 粉末与玻璃珠。
②打开止水夹K1、K2,向右推动注射器1的活塞,可观察到的现象是_____。
③实验过程中反应的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com