
【题目】Fe、N及S的化合物用途非常广泛。回答下列问题;
(1)基态Fe原子价电子排布图为____;基态S原子的核外电子占据最高能级的电子云轮廓图为__________形。
(2)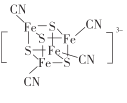 团簇离子中,Fe2+、Fe3+数目之比为______;与铁形成配位键的原子是________,铁的配位数为_________。
团簇离子中,Fe2+、Fe3+数目之比为______;与铁形成配位键的原子是________,铁的配位数为_________。
(3)四氟铵可通过下列反应制备:NF3+F2 + BF3 =NF4 BF4
①NF3的空间构型为_____ , 中心原子的杂化方式是______。
②NF4BF4存在的作用力有________(填字母)。
A. σ键 B. π键 C.离子键. D.配位键
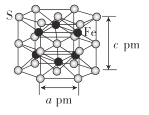
(4)Fe与S形成的一种化合物晶体的结构如图所示,六棱柱底边边长为a pm,高为c pm,阿伏加德罗常数的值为NA,该Fe、S化合物晶体的密度为_____(列出计算式)g. cm-3
【答案】![]() 哑铃(或纺锤) 3:1 S和C 4 三角锥形 sp3 ACD
哑铃(或纺锤) 3:1 S和C 4 三角锥形 sp3 ACD 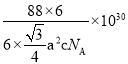
【解析】
(1) Fe为26号元素,其基态Fe原子价电子为3d64s2,基态S原子的核外电子占据最高能级是3p能级。
(2)团簇离子中,设Fe2+、Fe3+数目分别为x、y,建立方程计算;S与Fe形成三个价键,S最外层有6个电子,易形成2个价键,另外一个价键与Fe形成配位键,CN-中C有孤对电子,与Fe形成配位键,根据图中结构得出铁的配位数。
(3)①计算NF3的价层电子对数,得到中心原子的杂化方式,得到价层电子互斥理论模型,由于有1对孤对电子,因此得到空间构型;②A. NF4BF4中N—F,B—F之间为σ键;B. NF4BF4中N—F,B—F之间为单键,无π键;C. NF4BF4中NF4+、BF4-之间是离子键;D. NF4+、BF4-里都存在配位键。
(4)根据图分析得出S个数和Fe个数,再根据公式计算该化合物晶体的密度。
(1) Fe为26号元素,其基态Fe原子价电子为3d64s2,因此基态Fe原子价电子排布图为![]() ;基态S原子的核外电子占据最高能级是3p能级,其电子云轮廓图为哑铃(或纺锤)形;故答案为:
;基态S原子的核外电子占据最高能级是3p能级,其电子云轮廓图为哑铃(或纺锤)形;故答案为:![]() ;哑铃(或纺锤)。
;哑铃(或纺锤)。
(2) 团簇离子中,设Fe2+、Fe3+数目分别为x、y,因此x+y=4,2x + 3y+(2)×4+(1)×4 = 3,解得x =3,y=1,因此Fe2+、Fe3+数目之比为3:1;S与Fe形成三个价键,S最外层有6个电子,易形成2个价键,另外一个价键与Fe形成配位键,CN-中C有孤对电子,与Fe形成配位键,因此与铁形成配位键的原子是S、C;根据图中结构得出铁的配位数为4;故答案为:3:1;S、C;4。
团簇离子中,设Fe2+、Fe3+数目分别为x、y,因此x+y=4,2x + 3y+(2)×4+(1)×4 = 3,解得x =3,y=1,因此Fe2+、Fe3+数目之比为3:1;S与Fe形成三个价键,S最外层有6个电子,易形成2个价键,另外一个价键与Fe形成配位键,CN-中C有孤对电子,与Fe形成配位键,因此与铁形成配位键的原子是S、C;根据图中结构得出铁的配位数为4;故答案为:3:1;S、C;4。
(3)①NF3的价层电子对数![]() ,中心原子的杂化方式是sp3,价层电子互斥理论模型为四面体形,由于有1对孤对电子,因此空间构型为三角锥形;故答案为:三角锥形;sp3。
,中心原子的杂化方式是sp3,价层电子互斥理论模型为四面体形,由于有1对孤对电子,因此空间构型为三角锥形;故答案为:三角锥形;sp3。
②A. NF4BF4中N—F,B—F之间为σ键,故A符合题意;B. NF4BF4中N—F,B—F之间为单键,无π键,故B不符合题意;C. NF4BF4中NF4+、BF4-之间是离子键,故C符合题意;D. NF4+、BF4-里都存在配位键,故D符合题意;综上所述,答案为ACD。
(4)根据图分析得出S个数![]() ,Fe个数为6个,化学式为FeS,晶体的结构如图所示,六棱柱底边边长为a pm,底边面积为高为c pm,阿伏加德罗常数的值为NA,该Fe、S化合物晶体的密度为
,Fe个数为6个,化学式为FeS,晶体的结构如图所示,六棱柱底边边长为a pm,底边面积为高为c pm,阿伏加德罗常数的值为NA,该Fe、S化合物晶体的密度为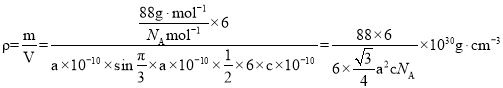 ;故答案为:
;故答案为: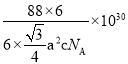 。
。


科目:高中化学 来源: 题型:
【题目】如图是制备重铬酸钾的实验装置示意图:
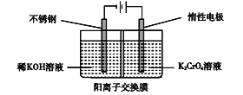
下列说法不正确的是
A.在阴极室,发生的电极反应为: 2H2O+2e- = 2OH -+ H2↑
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O向右移动
Cr2O72-(橙色)+H2O向右移动
C.该制备过程总反应为: 4K2CrO4 + 4H2O![]() 2K2Cr2O7 + 4KOH + 2H2↑+ O2↑
2K2Cr2O7 + 4KOH + 2H2↑+ O2↑
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比(nK/nCr)为d,则此时铬酸钾的转化率为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知溶解度也可用物质的量浓度表示,25℃时,Ag2CrO4在不同浓度CrO42-溶液中的溶解度如图所示。又知Ksp(AgCl)=1.8×10-10。下列说法正确的是
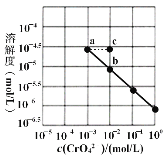
A.图中a、b两点c(Ag+)相同
B.该温度下,Ag2CrO4溶度积的数量级为10-12
C.加热蒸发饱和Ag2CrO4溶液再恢复到25℃,可使溶液由a点变到b点
D.将0.01 mol/L AgNO3溶液滴入20mL0.01 mol/L KCl和0.01 mol/L K2CrO4的混合溶液中,CrO42-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】VCB是锂离子电池的一-种添加剂,以环氧乙烷(EO)为原料制备VCB的一种合成路线如下:
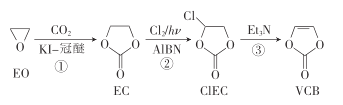
下列说法错误的是
A.反应①的原子利用率为100%
B.②的反应类型为取代反应.
C.EO、EC的一氯代物种数相同
D.CIEC、VCB分子中所有原子均处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米Fe2O3在常压电化学法合成氨过程中起催化作用。该电解装置如图所示。已知熔融NaOH-KOH为电解液,Fe2O3在阴极发生反应生成中间体Fe。下列说法不正确的是
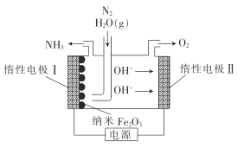
A.惰性电极II是电解池的阳极,发生氧化反应
B.生成氨气的反应:2Fe+N2+3H2O=Fe2O3+2NH3
C.惰性电极I的电极反应:Fe2O3+3H2O+6e -=2Fe+ 6OH-
D.产生2.24LO2时,转移的电子数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷矿石的主要成分是Ca5F(PO4)3,并含有少量MgO、Fe2O3等杂质。工业上以磷矿石为原料制备H3PO4,一种生产流程如下:

已知:Ca5F(PO4)3 + 7H3PO4→5Ca(H2PO4)2 + HF
38、写出有关操作的名称:Ⅰ___________、Ⅲ_________。工艺流程中设计操作Ⅱ与Ⅲ的目的是__________________________________。
39、若在实验室里采用此种方法溶解磷矿石,请写出必须的实验注意事项,并说明理由:_____________。
40、磷矿石也可直接用硫酸溶解,两种工艺相比,该工艺的优点是____________________。
41、测定产品磷酸的浓度可采用滴定法。准确量取10.00 mL磷酸产品(密度为1.526g/cm3)溶于水配成1L溶液;取稀释后的溶液20.00mL,以甲基橙为指示剂,用0.103 mol/L标准NaOH溶液滴定;当观察到溶液恰好变色,且在半分钟内不变色,即为滴定终点(生成NaH2PO4),消耗标准溶液20.16 mL。
该实验过程中需要的定量仪器有______________________________(写名称)。
42、若理论上滴定应耗用标准溶液20.20 mL,则相对误差为______________(按近似计算法则)。该产品中磷酸的质量分数为_____________(保留3位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,运用电离理论做出的预测正确的是
A.测定某二元弱酸钠盐溶液的pH,可能小于7
B.稀释0.1mol/LCH3COOH(aq),![]() 可能变大也可能变小
可能变大也可能变小
C.在20.00mL浓度均为0.100 mol/L的HCl与CH3COOH混合溶液中滴加0.200mol/LNaOH溶液至pH=7,NaOH溶液体积一定小于20.00mL
D.pH=8的碱性溶液中一定没有CH3COOH分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于具有超低耗电量、寿命长的特点,LED产品越来越受人欢迎。如图是氢氧燃料电池驱动LED发光的装置。
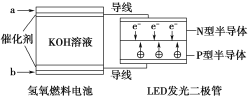
①a处通入的气体是氢气,b处通入的气体是氧气;
②该装置中只涉及两种形式的能量变化;
③电池正极的电极反应式为O2+2H2O+4e-=4OH-;
④P型半导体连接的是电池负极。上述说法中正确的是( )
A.①②B.①③C.③④D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示元素周期表中1~14周期的一部分,关于元素X、Y、Z、W的叙述错误的是( )
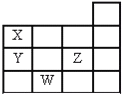
A.X、Y的最高价氧化物的水化物酸性为Y<X
B.Y、Z的气态氢化物的稳定性为Y<Z
C.Z有5种不同运动状态的电子
D.W的原子序数比Y大19
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com