
关于下列装置说法正解的是( )
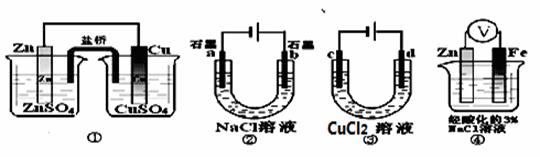
A.装置①中,盐桥中的Cl-移向CuSO4溶液
B.装置②工作一段时间后,a极附近溶液的pH降低
C.用装置③精炼铜时,c极为粗铜
D.装置④中电子由Zn流向Fe,Zn极发生氧化反应
科目:高中化学 来源: 题型:
世界卫生组织(WHO)将ClO2 列为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有广泛的应用。ClO2属于
A.酸 B.碱 C.氯化物 D.氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
具有解热镇痛及抗生素作用的药物“芬必得”主要成分的结构简式如下,它属于( ) 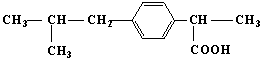
①芳香族化合物 ②脂肪族化合物 ③有机羧酸 ④有机高分子化合物 ⑤芳香烃
A.③⑤ B.②③ C.①③ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
关于中和热测定的说法错误的是( )
A.实验需用到的主要玻璃仪器包括大、小烧杯,温度计,环形玻璃搅拌棒及泡沫塑料板、碎泡沫塑料(或硬纸板、碎纸条)等;
B.盐酸与某强碱中和放出的热量随反应物用量的改变而改变,但中和热不变;
C.NaOH稍过量的目的是保证盐酸完全被NaOH中和;
D.测定结果准确与否的关键是尽量减小热量损失及准确读取混合溶液的最高温度等。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学用语是学习化学的重要工具,下列化学用语中,正确的是( )
A、电解饱和食盐水时,阳极的电极反应式为:2Cl- -2e-= Cl2 ↑
B、氢氧燃料电池的负极反应式:O2 + 2H2O + 4e- = 4OH-
C、镀件上电镀铜时,纯铜做阴极,电极反应式为:Cu -2e- = Cu2+
D、钢铁发生电化学腐蚀的正极反应式:Fe-2e- = Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
COCl2 (g) CO(g)+ Cl2(g) △H>0,当反应达到平衡时,下列措施①升温②恒容通入惰性气体③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
CO(g)+ Cl2(g) △H>0,当反应达到平衡时,下列措施①升温②恒容通入惰性气体③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A. ①②④ B. ①④⑥ C. ②③⑥ D. ③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
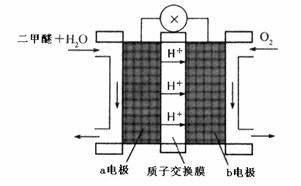
二甲醚(CH3OCH3)被称为21世纪界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g) △H1=-90.7kJ·mol-1
CH3OH(g) △H1=-90.7kJ·mol-1
②2CH3OH(g) CH3OCH3(g) +H2O(g) △H2=-23.5kJ·mol-1
CH3OCH3(g) +H2O(g) △H2=-23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1
(1)若要增大反应①中H2的转化率,在其它条件不变的情况下可以采取的措施为 。
A.加入某物质作催化剂 B.加入一定量CO C.反应温度降低 D.增大容器体积
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1 mol/L,c(H2)=2 mol/L,5 min后达到平衡,CO的转化率为50%,则5 min内CO的平均反应速率
为 ;
若反应物的起始浓度分别为:c(CO)=4 mol/L,c(H2)=a mol/L;达到平衡后,c(CH3OH)=2 mol/L,a= mol/L。
(3)催化反应室中总反应3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)的△H= 。
CH3OCH3(g)+CO2(g)的△H= 。
(4)“二甲醚燃料电池”是一种绿色电源,其工作原理如上图所示。b电极是 极,写出b电极上发生的电极反应式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
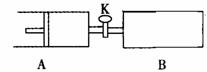 如图,关闭活塞K,向A中充入1 molX、1 molY,向B中充入2 molX、2 molY, 此时A的容积是a L,B的容积是2aL。在相同温度和催化剂存在的条件下,使两容器中各自发生下述反应:X(g)+Y(g)
如图,关闭活塞K,向A中充入1 molX、1 molY,向B中充入2 molX、2 molY, 此时A的容积是a L,B的容积是2aL。在相同温度和催化剂存在的条件下,使两容器中各自发生下述反应:X(g)+Y(g) 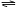 2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法错误的是( )
2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法错误的是( )
A.反应速率:v(B)>v(A) B.A 容器中X的转化率为80%
C.若打开K,则A的体积变为2.6a L D.平衡时Y的体积分数:A<B
查看答案和解析>>
科目:高中化学 来源: 题型:
痛风是关节炎反复发作及产生肾结石为特征的一类疾病,关节炎的原因归结于在关节滑液中形成了尿酸钠(NaUr)晶体,有关平衡如下:
①HUr(aq)  Ur- (aq)+H+(aq) (37℃时Ka=4.0×10-6)
Ur- (aq)+H+(aq) (37℃时Ka=4.0×10-6)
尿酸 尿酸根
②NaUr(s)  Ur- (aq)+Na+(aq)
Ur- (aq)+Na+(aq)
回答:
(1)37℃时,1.0L水中最多可溶解8.0×10-3mol尿酸钠,此温度下尿酸钠的Ksp为_____。
(2)关节炎发作多在脚趾和手指的关节处,这说明温度降低时,尿酸钠的Ksp____(填“增大”,“减小”或“不变”),生成尿酸钠晶体的反应是____(填“放热”或“吸热”)反应。
(3)37℃时,某尿酸结石病又尿液中尿酸分子和尿酸根离子的总浓度为2.0×10-3mol/L,其中尿酸分子的浓度为5.0×10-4mol/l,该病人尿液的c(H+)为__,pH__7(填“>”,“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com