
【题目】氧化还原反应与电化学及金属的防护知识密切相关。请回答下列问题:

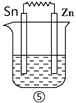
Ⅰ、依据反应: 2Ag+(aq)+Cu=== Cu2+ (aq) +2Ag设计的原电池如图1所示。则电解质溶液Y是___________ (填化学式),X的电极反应式__________________。若将盐桥换成铜丝,则X电极名称是____________。
Ⅱ、 用图2的装置进实验。
(1)若A为Zn,实验时开关K与a连接,则能模拟钢铁的一种电化学防护方法,名称为______。
(2)若A为石墨,将开关K与b连接,则有关该实验的说法正确的是(填序号)________。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润的蓝色石蕊试纸先变红后褪色
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则电路中转移0.2 mol电子
⑤电子流动方向:电源负极→B→饱和食盐水→A→电源正极
⑥若实验前滴入酚酞,B极区附近溶液先变红
Ⅲ、 如下图所示装置中都盛有0.1 mol/L的NaCl溶液,放置一定时间后,装置中的五块相同锌片,腐蚀速率由快到慢的正确顺序是______________。

【答案】 AgNO3 Cu-2e-=Cu2+ 阳极 牺牲阳极的阴极保护法 ②④⑥ ②>①>⑤>④>③
【解析】(1)若A为Zn,实验时开关K与a连接,构成原电池,锌是负极,铁正极,属于牺牲阳极的阴极保护法。(2)若A为石墨,将开关K与b连接,构成电解池,铁电极是阴极,溶液中的氢离子放电,石墨是阳极,氯离子放电,①溶液中Na+向阴极B极移动,①错误;②从A极处逸出的气体是氯气,能使湿润的蓝色石蕊试纸先变红后褪色,②正确;③反应一段时间后通入氯化氢可恢复到电解前电解质的浓度,③错误;④若标准状况下B极产生2.24 L气体,即氢气是0.1mol,则电路中转移0.2 mol电子,④正确;⑤电子不能通过溶液传递,⑤错误;⑥若实验前滴入酚酞,B极区附近产生氢氧化钠,溶液先变红,⑥正确,答案选②④⑥;
Ⅲ、金属腐蚀快慢顺序是:电解池阳极>原电池负极>化学腐蚀>原电池正极>电解池阴极,①中锌发生电化学腐蚀,金属锌是负极,加快锌的腐蚀;②中锌作电解池的阳极,被腐蚀;③中锌作电解池的阴极,被保护;④中Zn发生化学腐蚀;⑤中锌是负极,由于金属性铜大于锡,所以腐蚀速率由快到慢的顺序是②>①>⑤>④>③。


科目:高中化学 来源: 题型:
【题目】关于电解池的叙述不正确的是
A.与电源正极相连的是电解池的阴极
B.电解质溶液中的阳离子向阴极移动
C.在电解池的阳极发生氧化反应
D.电子从电源的负极沿导线流入电解池的阴极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【辽宁省葫芦岛协作体2017届高三下学期模拟考试(6月)】下列说法正确的是( )
A. 乙醇分子的比例模型: 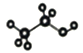
B. 蔗糖、麦芽糖、淀粉、纤维素完全水解都只生成葡萄糖
C. 《天工开物》 中“凡石灰,经火焚炼为用”里的“石灰”指的是Ca(OH)2
D. 许多国家十分重视海水资源的综合利用,从海水中可获得的物质有氧、溴、碘、钠、镁、铝、烧碱、氢气、食盐、淡水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【上海市浦东新区六校2017届高三下学期第二次学科调研考试】工业上常用如下的方法从海水中提碘:

完成下列填空:
(1)上述流程中有两步都涉及到氯气。写出氯元素在周期表中的位置:_________;
氯气分子中所含的化学键名称是:_________;在![]() 原子钟,其核外存在_________种运动状态不同的电子。
原子钟,其核外存在_________种运动状态不同的电子。
(2)和氯元素位于同主族的另外一个短周期元素单质的电子式是:_________,
两者气态氢化物的稳定性是:_________>_________(填写化学式)。
(3)步骤②中体现了溴具有的性质是_______________(文字简述)。
(4)写出步骤③中反应的化学方程式(说明:此反应在水溶液中进行):________________;在该反应中被氧化的元素是:_________。
(5)工业上利用海水还有一个重要的反应就是电解饱和食盐水,此反应中的阴极产物是:_________和_________(写化学式)。
(6)溴蒸汽还可以用饱和碳酸钠溶液来吸收,产物为溴化钠、溴酸钠,同时放出二氧化碳,请写出该反应的化学方程式并标明电子转移方向与数目:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 如图可表示水分解过程中的能量变化

B. 增大反应物浓度,是增大了活化分子百分数使反应速率增大。
C. 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应
D. 已知:Ⅰ:对于反应:H2(g)+Cl2(s)=2HCl (g) △H=- a kJ/mol,
Ⅱ: ![]() ,且a、b、c均大于零,则断开1molH-Cl键所需的能量为- a-b-c kJ
,且a、b、c均大于零,则断开1molH-Cl键所需的能量为- a-b-c kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟。如图是钒电池基本工作原理示意图:

请回答下列问题:
(1)钒电池是以溶解于一定浓度硫酸溶液中的不同价态的钒离子(V2+、V3+、VO2+、VO![]() )为正极和负极电极反应的活性物质,电池总反应为 V2++VO
)为正极和负极电极反应的活性物质,电池总反应为 V2++VO![]() +2H+
+2H+![]() VO2++V3++H2O。放电时的正极反应式为______________________,充电时的阴极反应式为_____________。
VO2++V3++H2O。放电时的正极反应式为______________________,充电时的阴极反应式为_____________。
(2)钒电池基本工作原理示意图中“正极电解液”可能是________。
a.VO![]() 、VO2+混合液 b.V3+、V2+混合液 c.VO
、VO2+混合液 b.V3+、V2+混合液 c.VO![]() 溶液
溶液
d.VO2+溶液 e.V3+溶液 f.V2+溶液
Ⅱ、氢气的制备和存储是氢氧燃料电池能否有效推广的关键技术。有人提出利用光伏发电装置电解尿素的碱性溶液来制备氢气。光伏发电是当今世界利用太阳能最主要方式之一。图1为光伏并网发电装置,图2为电解尿素[CO(NH2)2]的碱性溶液制氢气的装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。

(1)图1中N型半导体为__________(填“正极”或“负极”)
(2)该系统工作时,A极的电极反应式为________________
(3)若A极产生7.00gN2,则此时B极产生________L H2(标况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题
(1)Z元素在周期表中的位置为__________________。
(2)表中元素原子半径最大的是(写元素符号)________。
(3)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是________;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1 mol Y单质比1 mol S得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1 mol X的最高价化合物,恢复至室温,放热687 kJ,已知该化合物的熔、沸点分别为-69 ℃和58 ℃,写出该反应的热化学方程式:_________________________________。
(5)碳与镁形成的1 mol化合物Q与水反应,生成2 mol Mg(OH)2和1 mol烃,该烃分子中碳氢质量比为9∶1,烃的电子式为____________。Q与水反应的化学方程式为________________________。
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1 L 2.2 mol·L-1 NaOH溶液和1 mol O2,则两种气体的分子式及物质的量分别为________________________,生成硫酸铜物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学实验的说法正确的是
A. 测任何溶液pH时都可使用广泛pH试纸或精密pH试纸
B. 无水氯化钙可干燥CO2、Cl2、NH3、CO等常见气体
C. 用酒精灯加热烧瓶、烧杯、试管时都需要垫石棉网
D. 萃取、过滤都是利用物质的物理性质进行分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2015年普通高等学校招生全国统一考试(江苏卷)】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
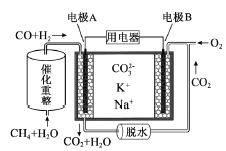
A.反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移12mol 电子
3H2+CO,每消耗1molCH4转移12mol 电子
B.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C.电池工作时,CO32-向电极B移动
D.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com